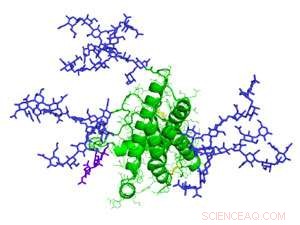
Un modello di eritropoetina, una glicoproteina coinvolta nella produzione di globuli rossi. I glicani sono indicati in viola. Credito:Mark Wormald, Istituto di glicobiologia di Oxford
In due settimane nel 2004, Song Zhiwei ha assistito alla lenta morte di una colonia di cellule. Canzone, un bioingegnere presso l'A*STAR Bioprocessing Technology Institute (BTI), aveva bagnato una piastra di cellule ovariche di criceto cinese (CHO) con lectina, una proteina tossica derivata dalle piante. Ha poi osservato i milioni di cellule ridursi a una dozzina di sopravvissuti. Sembravano nella media, ma Song sapeva che avevano dei superpoteri. Il segreto era nascosto nel dolcificante.
Gli zuccheri sono essenziali per la vita. Tra le classi più importanti di zuccheri ci sono quelli che sono attaccati chimicamente alle proteine. Queste glicoproteine sono coinvolte in tutto, dal riconoscimento degli invasori del sistema immunitario alla lubrificazione delle membrane e alla stimolazione della tiroide. Alimentano anche un'industria farmaceutica in forte espansione:molti farmaci domestici contengono glicoproteine, e le aziende biotecnologiche investono risorse significative nell'ottimizzazione dello zucchero di queste proteine per migliorarne la bioattività e la potenza terapeutica.
La lectina è nota per legarsi agli zuccheri che penzolano alle estremità delle glicoproteine. Nell'esperimento di Song, solo le cellule CHO mutanti che non hanno prodotto quegli zuccheri leganti potevano sopravvivere al trattamento con lectina. Questo approccio di "vedere cosa si attacca" è un metodo consolidato per identificare i mutanti che possono essere successivamente prodotti in serie dall'industria biotecnologica.
Song trascorse i due anni successivi conducendo esperimenti di coltura cellulare, studi di biologia molecolare e test genetici per dimostrare che le cellule erano effettivamente mutanti. La determinazione dell'esatta struttura delle glicoproteine mutanti ha richiesto l'aiuto del suo collega Lee May May, che guidava il gruppo di analisi di BTI. May ha utilizzato strumenti di spettrometria di massa per determinare l'esatta struttura biochimica delle proteine prodotte dalle cellule mutanti di Song, rivelando che mancavano di zuccheri chiave. Song aveva creato le prime linee cellulari mutanti dello zucchero applicabili alla produzione biotecnologica.
Da allora la collaborazione si è espansa in una partnership di fama mondiale tra bioingegneri e bioanalisti presso A*STAR, migliorare la comprensione del ruolo degli zuccheri nella malattia.
dolci chiacchiere
Gli zuccheri sono la forma più piccola e semplice di carboidrati, costituito da unità molecolari di carbonio singole o connesse, idrogeno e ossigeno. Il nostro sangue contiene centinaia di tipi di zuccheri:alcuni galleggiano liberamente, ma molti altri attaccati alle proteine come decorazioni su un albero di Natale. Quasi il 70% delle proteine del nostro corpo sono glicosilate, il che significa che non funzioneranno senza il loro equipaggiamento zuccherino. La disposizione specifica degli zuccheri, o glicani, su una glicoproteina determina come una proteina si ripiega e interagisce con altre molecole, altera la sua solubilità e talvolta anche i messaggi che trasmette alle cellule. "La cellula spende un'enorme quantità di energia per mettere gli zuccheri sulle proteine, "dice Pauline Rudd, un veterano nel campo della glicobiologia, che è entrato a far parte del team di analisi BTI nel 2015. "Se non avessi zuccheri, non sopravviveresti."
I ricercatori hanno scoperto per la prima volta il ruolo critico delle glicoproteine all'inizio del 1900. Un medico austriaco, Karl Landstein, notò che il sangue umano si mescolava al sangue degli animali, o anche altri umani, forma grumi. Questi grumi possono ostruire i vasi o rompersi per rilasciare proteine tossiche nel corpo. Però, Landsteiner notò che alcune miscele non coagulavano. Questa scoperta lo portò alla classificazione dei gruppi sanguigni ancora utilizzata oggi:A, B, AB e O, e gli valsero il Premio Nobel per la fisiologia o la medicina nel 1930. Negli anni '50 i ricercatori stabilirono che gli zuccheri esposti sulla superficie dei globuli rossi determinavano a quale gruppo sanguigno appartenevano.
L'analisi del sangue ha incoraggiato la ricerca sulle glicoproteine. Entro gli anni '90, i biologi sono stati coinvolti nella mania della genetica. La cura per tutto, hanno posto, era nascosto nel nostro DNA. "Si diceva che i geni fossero la causa di tutto, "dice Rudd, che ha visto svanire i fondi per la glicobiologia. Tra il 1998 e il 2000, 3,5 miliardi di dollari sono stati spesi a livello globale per la ricerca genomica, compresa l'iniziativa di sequenziare l'intero genoma umano. "C'erano molte informazioni ma non ci davano una via diretta per comprendere la malattia, " dice Rudd. "La gente ha cominciato a suggerire che forse i geni non fanno altro che codificare per le proteine".
Gli scienziati hanno spostato la loro attenzione sui molti altri stadi dell'attività biologica fino a quando non sono arrivati di nuovo agli zuccheri.
"Il DNA è il primo strato di informazioni. Queste informazioni sono trascritte nell'RNA, che invia un messaggio che viene tradotto in una proteina con una funzione, " dice Song. "Carboidrati, o zuccheri, sono l'ultimo strato di informazioni biologiche."
Conoscere l'importanza degli zuccheri non li ha resi più facili da studiare. Il DNA e le proteine sono essenzialmente strutture lineari che "si arricciano in forme fantasiose, " dice Rudd. Gli zuccheri si diramano in più catene. "Sono come grandi alberi che pendono dai lati delle proteine." Ci vorrebbero diversi anni prima che gli zuccheri possano essere analizzati con la precisione e la velocità di geni e proteine.
Scuotere
Nel 1989 un terremoto colpì la California. Rudd lo ricorda bene. Era profondamente coinvolta in una collaborazione tra l'Oxford Glycobiology Institute (guidato dal direttore Raymond Dwek) e un team di ricerca a Londra, alla ricerca di cambiamenti nel modo in cui le proteine vengono glicosilate nei pazienti con malattie autoimmuni. Stava analizzando 600 campioni della proteina immunoglobulina G (IgG), utilizzando un gel speciale per filtrare gli zuccheri. La fabbrica che produceva questo gel è stata distrutta dal terremoto.
Quando la fabbrica fu ricostruita, il suo gel non era lo stesso. "Era completamente inutile, " ricorda Rudd. "Mi stavo strappando i capelli cercando di far analizzare questi 600 campioni."
La necessità genera invenzione, così Rudd si guardò intorno e notò le colonne di cromatografia liquida (LC) che stava usando per ordinare le proteine. Infilò nelle colonne una siringa riempita con una miscela di zuccheri rilasciati dai suoi campioni di glicoproteina. Il dispositivo LC ha filtrato gli zuccheri a una risoluzione molto più elevata rispetto al processo di gel. "Non siamo mai tornati, " lei dice.
Da allora, Rudd ha collaborato con partner privati e istituzionali per accelerare, automatizzare e migliorare la specificità delle tecniche di selezione e caratterizzazione degli zuccheri da un campione. Quello che prima richiedeva un anno, ora può essere fatto in un giorno. Il flusso di lavoro, bioinformatica e database sviluppati dal team di Rudd presso l'Istituto nazionale per la ricerca e la formazione sui bioprocessi (Dublino, Irlanda) sono stati incorporati nella piattaforma di cromatografia liquida/spettrometria di massa accoppiata analitica UNIFI di Waters Corporation, il che significa che gran parte della complessità della glicoanalisi è ora automatizzata. Quindi, la glicoanalisi è entrata in una nuova era della glicomica, avvicinandolo all'universo dei big data della genetica, trascrittomica e proteomica.
"Ora possiamo esaminare ampie coorti di campioni per capire di più sulle malattie e per supportare lo sviluppo e la produzione biologica, "dice Terry Nguyen-Khuong, che guida il gruppo di analisi di BTI. Da quando ha collaborato con Rudd, A*STAR ha ampliato il suo portafoglio di analisi per ingrandire gli zuccheri e identificare la loro posizione esatta, elementi di base e strutture di collegamento.
Glicoproteine farmaceutiche
Le glicoproteine alimentano un'industria biofarmaceutica da 163 miliardi di dollari la cui efficacia può essere dettata dagli zuccheri. Per esempio, quando l'ormone eritropoietina è adornato con zuccheri dell'acido sialico, è dieci volte più efficace nello stimolare la produzione di globuli rossi nei pazienti anemici rispetto al solo ormone.
Nel business della glicoproteina, Le cellule CHO comprendono l'intera forza lavoro. Possono produrre qualsiasi proteina richiesta dall'industria biotecnologica, e possono ricoprire di zucchero le proteine allo stesso modo degli esseri umani.
Prima che Song creasse i suoi primi mutanti di cellule CHO, nessuno era stato in grado di controllare la glicosilazione delle proteine nelle linee cellulari producibili in massa. Il gruppo di Pamela Stanley negli Stati Uniti ha modificato per anni la glicosilazione delle cellule CHO utilizzando linee cellulari che vivevano e morivano su una capsula di Petri piatta, nutrito con sangue di vacca ricco di proteine. Song invece sviluppò mutanti usando cellule che sapeva potevano replicarsi indefinitamente mentre vorticavano nella sfera 20, Bioreattori da 000 litri utilizzati nelle fabbriche biofarmaceutiche, privi di additivi bovini.
Ha chiamato la linea cellulare CHO-glicosilazione mutante 1 (GMT-1), e da allora, più di venti successori si sono succeduti in ordine numerico. Quando sono emersi strumenti che hanno reso la modifica dei geni semplice come tagliare e incollare parole sullo schermo di un computer, li ha usati per generare più mutanti.
In GMT-3, ha cancellato un gene necessario per fissare gli zuccheri fucosio alle proteine. Le glicoproteine GMT-9 mancano degli zuccheri fucosio e galattosio; e GMT-17 manca di fucose, galattosio e acido sialico. L'assenza di questi zuccheri può dettare la potenza dei farmaci. Le cellule di Song producono anticorpi che sono fino a cento volte migliori nell'uccidere le cellule cancerose rispetto ai loro farmaci equivalenti sul mercato, come il rituximab (con marchio Rituxan) per il trattamento della leucemia. "Le linee cellulari sono paragonabili alle linee industriali e sono pronte per la commercializzazione, "dice Canzone, che gestisce una sovvenzione glicomica di $ 11 milioni chiamata GlycoSing dal 2014. I trattamenti con questi anticorpi migliorati significherebbero dosi significativamente ridotte.
Nel 2008, Andre Choo, un ricercatore presso BTI, sviluppato i primi anticorpi che potrebbero uccidere specificamente le cellule staminali embrionali, alleviare le preoccupazioni circa le cellule che formano i tumori nei pazienti trapiantati. Da allora gli anticorpi sono stati concessi in licenza a diverse aziende.
Molte malattie hanno un profilo zuccherino distinto, un concetto che Choo ha iniziato a sfruttare per la terapia del cancro. Cerca gli anticorpi che colpiscono specificamente le molecole di zucchero aberranti sulla superficie delle cellule tumorali, lavorando con Rudd e il team di Nguyen-Khuong per analizzarli.
Recentemente quest'anno, il suo team ha generato un anticorpo che riconosce gli zuccheri espressi sulle cellule del cancro ovarico. "In passato avremmo generato un anticorpo senza sapere veramente cosa mirasse, ora siamo concentrati sul tentativo di ottenere questi anticorpi anti-glicani".
All'A*STAR, la ricerca si è estesa alla dengue, il virus Zika e le malattie cardiache. "Tutte le principali aree della medicina:cancro, malattie infettive e problemi infiammatori - sono legati alle glicoproteine, "dice Canzone, i cui mutanti potrebbero potenzialmente curare queste malattie.