Questo fungo è pieno di sorprese:il fungo jack-o'-lantern si illumina al buio e produce peptidi che potrebbero essere utili per l'uomo. Credito:Noah Siegel, wikicommons, CC BY-SA 3.0
I microbiologi dell'ETH guidati da Markus Künzler hanno scoperto un notevole enzima in un fungo. Ora vogliono usarlo per sviluppare nuovi farmaci.
I funghi sembrano offrire una riserva davvero inesauribile di nuove sostanze. Uno di questi funghi è il fungo jack-o'-lantern (Omphalotus olearius), che si trova in tutta la regione mediterranea e ha un corpo fruttifero che si illumina al buio.
Ma non è questo effetto speciale che interessa i ricercatori medici; è un enzima scoperto di recente dai ricercatori dell'ETH guidati dal microbiologo Markus Künzler.
Questo enzima, OphA, costituisce una parte fondamentale di un percorso metabolico che tiene lontani i parassiti dal fungo jack-o'-lantern. "I funghi si proteggono dai predatori e dai concorrenti utilizzando un cocktail di tossine, molti dei quali sono proteine o peptidi, "dice Künzler.
Il fungo jack-o'-lantern utilizza l'enzima OphA per fornire la spina dorsale di uno di questi peptidi con gruppi metilici aggiuntivi. Solo su questa alterazione chimica e successiva ciclizzazione il peptide, onfalotina A, funzionare come una tossina. Il fungo lo usa per allontanare i parassiti come i nematodi.
Una linea di produzione difficile da manipolare
I peptidi fungini servono anche come farmaci in medicina. Uno dei più noti è la ciclosporina A, che è stato utilizzato nei trapianti di organi, malattie autoimmuni e medicina del cancro da quasi 40 anni.
Questo peptide trasporta gruppi metilici sulla sua spina dorsale come onfalotina A. La forma ad anello e i gruppi metilici sono responsabili delle vantaggiose caratteristiche farmacologiche della ciclosporina A, in particolare la sua disponibilità per via orale, fattore che attualmente rappresenta un ostacolo significativo per i farmaci a base di peptidi.
A differenza dell'onfalotina A, la cui spina dorsale, come quello della maggior parte delle proteine e dei peptidi in una cellula, è prodotto dal ribosoma, la ciclosporina A è costituita da amminoacidi da un enorme enzima dedicato a questo compito. Questo enzima funziona in modo molto simile a una linea di produzione nell'industria automobilistica. "Però, è difficile alterare biotecnologicamente questa linea di produzione per produrre varianti di ciclosporina A, "dice Künzler.
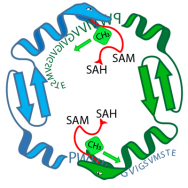
L'enzima OphA (serpenti verdi e blu) fornisce a un peptide precursore dell'onfalotina A (sequenza di lettere) gruppi metilici. Durante questa fase, l'enzima e il peptide sono legati. Credito:Niels van der Velden, Mike Freeman / ETH Zurigo
Creazione di nuovi peptidi a forma di anello
Utilizzando l'enzima OphA, però, potrebbe essere possibile creare nuovi peptidi a forma di anello piuttosto che semplici varianti di onfalotina A. Grazie ai gruppi metilici ad essi collegati, questi nuovi peptidi avrebbero caratteristiche farmacologiche altrettanto vantaggiose di quelle della ciclosporina A.
Questa possibilità è dovuta al fatto che i peptidi modificati da OphA sono prodotti ribosomialmente e quindi possono essere facilmente alterati tramite modifiche ai geni che codificano per i peptidi. Inoltre, OphA sembra essere meno selettivo sui peptidi che può alterare chimicamente. L'enzima è quindi in grado di legare gruppi metilici a un'ampia gamma di peptidi diversi.
"Possiamo produrre peptidi di partenza biotecnologicamente diversi e modificarli utilizzando OphA, che potrebbe consentirci di creare peptidi completamente nuovi con caratteristiche farmacologicamente vantaggiose, " spiega Künzler.
OphA consente quindi la produzione di librerie di peptidi a forma di anello con gruppi metilici come base per lo sviluppo di farmaci peptidici. Queste librerie di peptidi potrebbero quindi essere esaminate per peptidi che mostrano una caratteristica biologica desiderata, come la capacità di legarsi a una proteina bersaglio nella terapia del cancro.
A causa dei gruppi metilici attaccati, i peptidi così identificati hanno un'alta probabilità di manifestare caratteristiche farmacologiche vantaggiose. Ciò significa che rappresentano promettenti peptidi guida per lo sviluppo delle rispettive terapie peptidiche. "Questo approccio offre chiari vantaggi in termini di efficienza dei costi e probabilità di successo rispetto agli approcci in cui i gruppi metilici vengono introdotti solo successivamente nel peptide, "dice il microbiologo.
L'ETH di Zurigo ha richiesto un brevetto per l'uso di OphA e dei relativi enzimi per inserire gruppi metilici nei peptidi ribosomiali e per la procedura utilizzata per creare librerie di peptidi corrispondenti. Künzler ha ricevuto una borsa di studio CTI, attualmente senza un partner industriale, fornire la prova di principio che la tecnologia funziona. Si discute anche di uno spin-off. "Però, dobbiamo fornire la prova del concetto per la tecnologia prima di poter iniziare a raccogliere fondi per un potenziale spin-off." I prossimi due anni probabilmente creeranno o distruggeranno questo piano.
Esperti entusiasti
I risultati di Künzler sono stati accolti con entusiasmo dagli esperti del settore. L'interesse per il suo sistema era alto in una recente conferenza sui peptidi in Canada, e una società ha anche espresso interesse ad acquisire una licenza sul brevetto. "È divertente guidare la ricerca fondamentale verso applicazioni pratiche, "dice Künzler.
Crede che i funghi abbiano il potenziale per fornire una vasta gamma di agenti naturali. Esistono milioni di specie diverse di funghi, e il numero di sostanze naturali promettenti è corrispondentemente grande. Però, rimane un realista e riconosce che solo una piccola parte di questi sarà applicabile come droga. Forse alcuni di quelli della sua collezione di peptidi saranno tra questi.