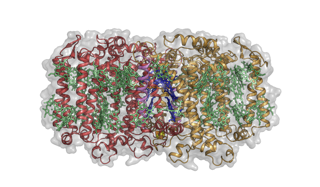
Struttura dell'Heliobacterium modesticaldum centro di reazione fotosintetica-fotosistema. Credito:Christopher Gisriel
Un team di scienziati della School of Molecular Sciences dell'ASU e della Pennsylvania State University ci ha avvicinato di un passo alla scoperta dei segreti della fotosintesi, e possibilmente a combustibili più puliti.
La loro scoperta è stata recentemente pubblicata online in Scienza e descrive la struttura di un centro di reazione (da un eliobatterio) che conserva le caratteristiche di quello ancestrale, e così fornisce nuove informazioni sull'evoluzione della fotosintesi.
La fotosintesi è il processo biologico più importante che guida la biosfera. Sfrutta l'energia della luce solare, e ci fornisce le nostre principali fonti di cibo e carburante. Lo studio della fotosintesi ha permesso agli scienziati non solo di comprendere le complessità di come gli organismi usano la luce per guidare il loro metabolismo, ma ha anche aperto la strada ai progressi tecnologici verso le fonti energetiche sostenibili.
"Il processo fotosintetico è nato per la prima volta circa 3 miliardi di anni fa, prima che l'atmosfera terrestre contenesse ossigeno, "ha detto Kevin Redding, un professore nella Scuola di Scienze Molecolari del College of Liberal Arts and Sciences, il cui gruppo sta conducendo la ricerca presso l'ASU. "La fotosintesi funziona utilizzando proteine di membrana specializzate, chiamati centri di reazione fotosintetici, che raccolgono l'energia dalla luce e la usano per pompare elettroni attraverso una membrana biologica da un trasportatore di elettroni cellulare a un altro, con conseguente conversione di energia elettromagnetica (cioè luce) in energia chimica, che l'organismo può utilizzare."
Una grande quantità di ricerche ha determinato che questi centri di reazione sono apparsi solo una volta sul pianeta, e da allora si sono diversificati per eseguire diversi tipi di chimica.
Nonostante la diversificazione, i centri di reazione mantengono la stessa architettura complessiva, riflettendo la loro comune origine. Negli ultimi 3 miliardi di anni queste proteine sono state elaborate e modificate ed è stato difficile ricostruire cosa sia successo in questo enorme lasso di tempo. Però, sappiamo che uno di loro ha sviluppato la capacità di ossidare l'acqua, rilasciando ossigeno. Questo ha cambiato il mondo irrevocabilmente, e ha permesso la vita come la conosciamo oggi.
Il team ritiene che il primo centro di reazione (RC) fosse molto più semplice delle versioni esistenti oggi. Per quanto riguarda la struttura proteica, era un omodimero, cioè due copie dello stesso polipeptide si sono unite per formare una struttura simmetrica. I centri di reazione le cui strutture conosciamo sono tutti eterodimeri in cui questa simmetria intrinseca è stata rotta, sebbene nel loro cuore conservino ancora le vestigia dell'originale architettura simmetrica.
L'eliobatterio dell'articolo in Scienza è un membro del più primitivo dei batteri fotosintetici, batteri che non producono ossigeno, infatti, sono completamente intolleranti all'ossigeno, come i primi organismi. Inoltre non possono fissare l'anidride carbonica dall'atmosfera e devono utilizzare fonti di carbonio organico. Importante per questo studio, il loro RC è un omodimero.
Così, questa è la prima struttura RC omodimerica e fa luce in diversi modi su come poteva essere l'RC ancestrale. Per molti versi l'architettura complessiva della proteina è molto simile ai fotosistemi delle piante e dei cianobatteri e al RC dei batteri sulfurei viola. Però, costruite su quell'architettura comune ci sono alcune differenze chimiche cruciali che si traducono in una chimica diversa da quella delle RC note, compresa la loro capacità di utilizzare vettori sia solubili in acqua che liposolubili, una capacità precedentemente ritenuta limitata all'uno o all'altro tipo di RC.
Questo lavoro è il risultato di una collaborazione tra Kevin Redding, Raimund Fromme, professore associato di ricerca presso la Scuola di Scienze Molecolari e ricercatore presso il Centro di Biologia Strutturale Applicata del Biodesign Institute, e John Golbeck della Pennsylvania State University.
Redding e Golbeck avevano deciso 8 anni fa di unire le forze per affrontare l'RC eliobatterico. Hanno combinato le loro sovvenzioni individuali del Dipartimento dell'Energia in una sovvenzione congiunta, che da allora è stato rinnovato due volte:la terza iterazione è iniziata un anno fa. Fromme si è unito ufficialmente al gruppo circa 4 anni fa, sebbene avesse precedentemente lavorato sulla cristallografia del RC con Iosifina Sarrou, un borsista post-dottorato nel gruppo di Redding che aveva ottimizzato la sua purificazione. Il lavoro è davvero decollato quando Christopher Gisriel, uno studente di dottorato nel gruppo Redding, ha iniziato a lavorare con Fromme per cristallizzare l'RC.
"Attribuisco a Chris e Raimund il merito di aver fatto ciò che era necessario per ottenere questa struttura, "disse Reding, che è anche direttore del Centro di Bioenergia e Fotosintesi dell'ASU.
"L'esperienza di Raimund nella cristallizzazione delle proteine di membrana e nella soluzione della loro struttura è stata cruciale. Chris ha fatto il duro lavoro di migliorare la purificazione, ottimizzare le condizioni di cristallizzazione, e portando i suoi cristalli alle linee di luce numerose volte. E poiché la proteina è intrinsecamente sensibile all'ossigeno, ha dovuto fare tutta la purificazione e la cristallizzazione in un vano portaoggetti!"
"Questo è il momento che un cristallografo sta aspettando, " disse Fromme, spiegando gli anni che possono essere necessari per far crescere il cristallo proteico perfetto adatto agli studi a raggi X.
Redding continuò, "Sono stati in grado di ottenere la qualità della diffrazione da una risoluzione di ~10 Å a 2-2,5 Å in pochi anni di duro lavoro... e poi è arrivato il compito titanico di risolvere la struttura. Chris ha iniziato con un modello molto ridotto di come potrebbe essere l'RC, sulla base delle somiglianze previste con il fotosistema cianobatterico I, e poi ci ho lavorato costantemente per mesi. Ha dovuto imparare da solo un nuovo software e lavorare lunghe notti per arrivarci. Una volta che aveva qualcosa che sembrava reale, Raimund è stato in grado di prenderlo e spingerlo al livello successivo. E lavorando insieme hanno prodotto una struttura davvero bella ad altissima risoluzione."
"Chris è un veterano dell'esercito americano, avendo prestato servizio in Afghanistan, " Redding ha detto. "È venuto all'ASU come specialista in biochimica e ha iniziato a lavorare nel mio laboratorio come ricercatore universitario. Non avendo mai preso seriamente in considerazione la possibilità di una carriera nella ricerca prima, all'inizio non era sicuro di quanto lontano volesse percorrere questa strada. Però, ben presto sviluppò un gusto per esso, e poi mi ha spinto a permettergli di intraprendere il progetto di cristallografia RC come studente del Master. L'ho messo in guardia contro di esso, sapendo quanto sarebbe stato difficile e le scarse possibilità di successo, ma ha insistito, e alla fine ho ceduto. In seguito ha deciso di perseguire un dottorato. Difenderà la sua tesi alla fine di questo semestre e non potrei essere più orgoglioso di lui".
"Questo centro di reazione si trova solo negli organismi che possono vivere in ambienti privi di ossigeno, come quello della Terra primitiva, " Ha detto Gisriel. "Questo lavoro ha aperto la porta agli scienziati di tutto il mondo per confrontare le caratteristiche del centro di reazione primitivo con quelle dei centri di reazione più avanzati che risiedono in organismi tolleranti all'ossigeno. Di conseguenza, stiamo ottenendo un quadro più chiaro e informato di come la natura ha ottimizzato la raccolta di energia guidata dalla luce".