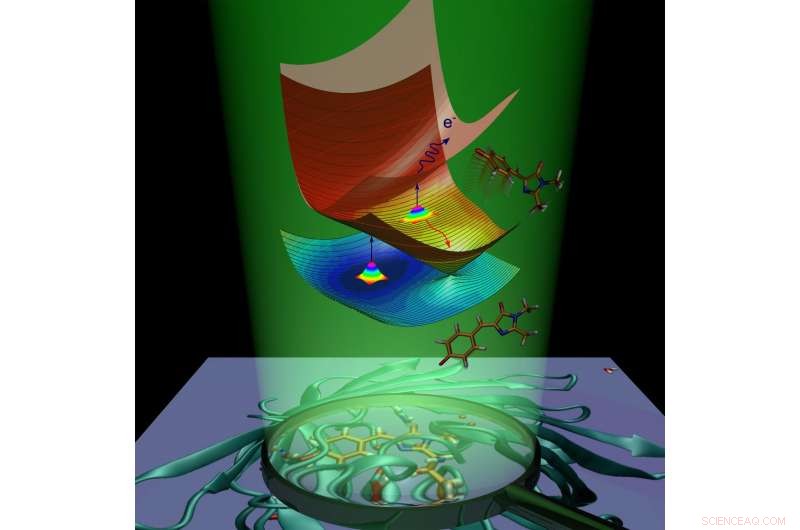
Dinamica molecolare del cromoforo della proteina fluorescente verde causata dall'assorbimento della luce. Attestazione:Anastasia Bochenkova
I ricercatori della Lomonosov Moscow State University, in collaborazione con fisici molecolari danesi, hanno rivelato il meccanismo che determina la sensibilità della proteina fluorescente verde all'esposizione alla luce. Gli scienziati hanno dimostrato che un gruppo cromoforo isolato è in grado di emettere luce al di fuori dell'ambiente proteico, mentre la funzione della proteina è quella di potenziare le sue proprietà fluorescenti. I risultati sono pubblicati nel Giornale della Società Chimica Americana .
Le proteine della famiglia GFP sono ampiamente utilizzate come biomarcatori. Con il loro aiuto, i ricercatori potrebbero visualizzare i processi biologici che avvengono all'interno delle cellule viventi. Queste proteine sono ampiamente utilizzate nella biologia molecolare e cellulare grazie alla loro capacità unica di emettere fluorescenza all'assorbimento della luce di una certa lunghezza d'onda.
gruppi cromofori, o cromofori, sono responsabili dell'assorbimento della luce. Il cromoforo è composto da soli tre residui di amminoacidi. Fino ad ora, i ricercatori ritenevano che l'ambiente proteico provocasse l'emissione di luce del suo cromoforo sotto irraggiamento. Questa idea è stata supportata dal fatto che il cromoforo isolato perde le sue proprietà fluorescenti alla denaturazione delle proteine, cioè lo spiegamento della proteina. Per la prima volta, gli autori hanno previsto e dimostrato sperimentalmente che il cromoforo isolato può anche emettere fluorescenza al di fuori dell'ambiente proteico, ma solo a determinate temperature.
Dopo l'assorbimento della luce, la proteina fluorescente guadagna energia extra e subisce la transizione allo stato eccitato elettronicamente. La molecola proteica sta cercando di tornare allo stato fondamentale eliminando l'energia in eccesso. Questo processo è chiamato disattivazione e procede in due modi. Il primo è la fluorescenza. In transito dallo stato eccitato allo stato fondamentale, il cromoforo emette energia sotto forma di luce, e come risultato, la proteina diventa luminosa.
Il secondo modo è chiamato rilassamento non radiativo. Durante questo processo, energia di eccitazione elettronica, trasferito a una molecola per assorbimento della luce, si trasforma in energia vibrazionale dei nuclei. La conversione interna all'interno della proteina fluorescente verde è seguita da una reazione chimica:isomerizzazione cis-trans del cromoforo (cioè rotazione intramolecolare attorno a uno dei doppi legami all'interno della molecola).
Nel caso del cromoforo anionico (caricato negativamente) della proteina fluorescente verde, l'energia può anche essere trasferita a un elettrone, che esce dal cromoforo. Il cromoforo, che subisce isomerizzazione o perde un elettrone, rimuove l'energia elettronica in eccesso e non emette fluorescenza. La fluorescenza è chiamata canale radiativo di disattivazione, mentre la conversione interna e l'emissione di elettroni sono chiamate canali non radiativi. Gli scienziati hanno utilizzato sperimentalmente entrambi i canali non radiativi per studiare il decadimento dello stato eccitato e il ripristino dello stato fondamentale del cromoforo GFP isolato a varie temperature.
Gli scienziati hanno dimostrato che il cromoforo GFP isolato può essere intrappolato nello stato eccitato a causa della presenza di barriere energetiche intrinseche lungo le vie di disattivazione non radiativa. Quando il cromoforo viene raffreddato a 100 K, l'intrappolamento dura per nanosecondi, abilitando così il canale radiativo lento. Le barriere di intrappolamento impediscono al cromoforo di tornare allo stato fondamentale mediante una rapida conversione non radiativa e provocando la fluorescenza della molecola.
La chimica Anastasia Bochenkova dell'Università statale di Mosca Lomonosov afferma:"Il cromoforo GFP è intrinsecamente fluorescente. Le interazioni tra il gruppo cromoforo e l'ambiente proteico più vicino migliorano le condizioni per intrappolare il cromoforo nello stato eccitato, migliorando così la fluorescenza molecolare. Di conseguenza, il canale radiativo diventa predominante all'interno della proteina già a temperatura ambiente."
Gli scienziati hanno studiato le proprietà del cromoforo sia teoricamente che sperimentalmente. Gli scienziati hanno elaborato un modello teorico e stimato una vita in stato eccitato del cromoforo isolato, basato su calcoli di chimica quantistica di alto livello. Tali calcoli richiedono risorse di calcolo ad alte prestazioni, e gli scienziati hanno utilizzato il Centro di supercalcolo Lomonosov per i loro studi.
Gli scienziati danesi hanno progettato e creato una nuova tecnica sperimentale per studiare la dinamica molecolare indotta dalla luce di cromofori carichi isolati nella spettroscopia d'azione di pompa-sonda a femtosecondi con risoluzione temporale 2-D. Sono stati variati sia il tempo di ritardo tra due impulsi laser a femtosecondi che il tempo di decadimento di una particolare azione molecolare. La nuova tecnica risolve la dinamica indotta dalla luce del cromoforo GFP come avviene in diversi canali di decadimento attraverso gli stati elettronici eccitati e di massa, a seconda della temperatura. In base ai risultati, i ricercatori hanno concluso che i cromofori GFP nativi sono intrinsecamente in grado di emettere fluorescenza al di fuori dell'ambiente proteico con una durata di nanosecondi, supportando pienamente le previsioni teoriche.
Anastasia Bochenkova dice, "La nostra ricerca mira a svelare i meccanismi molecolari di funzionamento dei sistemi viventi. Una sfida fondamentale è comprendere la relazione tra le proprietà di un intero biosistema fotosensibile e il suo cromoforo attivo molto più piccolo, che è il cuore della macchina molecolare. Qui, abbiamo dimostrato che le proprietà di un singolo cromoforo sono importanti per comprendere i meccanismi di azione dell'intera proteina GFP. Questa conoscenza è all'intersezione della fisica, chimica e biologia, e si traduce nella revisione del paradigma prevalente sul ruolo dell'ambiente proteico nella fluorescenza della proteina GFP. Oltre a risolvere la questione sull'origine della fluorescenza intrinseca della GFP, il lavoro mostra che la conoscenza molecolare dettagliata ottenuta attraverso calcoli di chimica quantistica di alto livello può essere utilizzata insieme all'ingegneria molecolare nella progettazione di nuovi biomateriali funzionali con una fotorisposta ottimale".