Ricerca recentemente pubblicata in Comunicazioni sulla natura esamina le capacità di una proteina umana che inibisce l'HIV-1, APOBEC3G (A3G). Il documento mette in evidenza il lavoro del professore di fisica nordorientale e presidente Mark Williams, ricercatore post-dottorato Mike Morse, Professoressa Linda Chelico, Università del Saskatchewan in Canada, e Ioulia Rouzina, Università statale dell'Ohio. Credito:Mike Morse/Northeastern University
Quindici anni fa, è stata scoperta una classe di proteine, che conferiscono agli esseri umani l'immunità innata all'HIV-1. Sfortunatamente, L'HIV-1 è un virus intelligente e si è evoluto per combattere queste proteine. Ricercatori del nordest, con l'aiuto dei suoi collaboratori, hanno studiato queste proteine per diversi anni per aiutare a comprendere ulteriormente la loro funzione e meccanismi nella speranza di essere meglio preparati contro l'HIV-1.
La ricerca, pubblicato in Comunicazioni sulla natura , mette in evidenza il lavoro del professore di fisica nordorientale e presidente Mark Williams, ricercatore post-dottorato Mike Morse, Professoressa Linda Chelico, Università del Saskatchewan in Canada, e Ioulia Rouzina, Università statale dell'Ohio. Il documento esamina le capacità di una proteina umana che inibisce l'HIV-1, APOBEC3G (A3G).
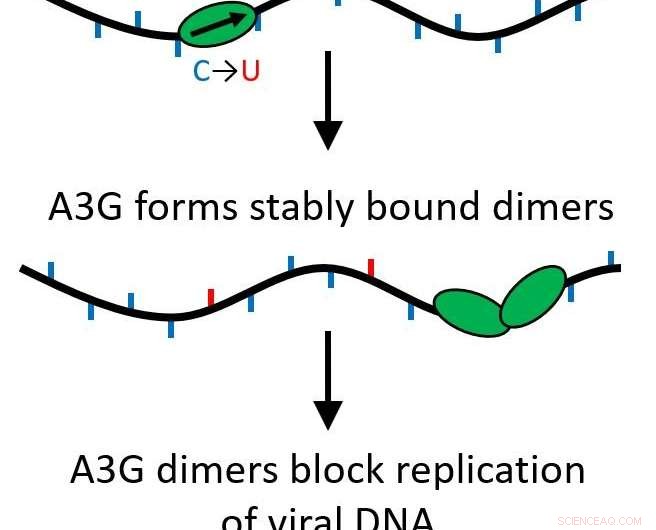
Le loro scoperte hanno determinato che quando la proteina A3G cresce da una singola proteina (monomero) a un complesso di due proteine (dimero), la sua funzione si trasforma dall'essere una proteina di modifica che muta il DNA virale ad agire come un ostacolo per un'ulteriore replicazione del virus.
"Sono rimasto completamente sorpreso dal risultato che i dimeri erano sufficienti per farlo, " ha detto Williams. "Abbiamo ottenuto i nostri dati, e i dati ci hanno detto questo, ma ci è voluto molto tempo per capire che l'unico modo per comprendere questi dati è che i dimeri devono essere il modello affinché le proprietà della proteina cambino improvvisamente".
Il Williams Laboratory for Single Molecule Biophysics è specializzato in strumenti chiamati pinzette ottiche che studiano molecole come singole molecole di DNA o complessi DNA-proteina. Questo strumento tiene il DNA o l'RNA tra due perline di polistirene per osservare le interazioni con il DNA osservando i cambiamenti nella sua lunghezza e tensione. Utilizzando questa tecnica, il laboratorio studia molti diversi sistemi biologici inclusa la replicazione dell'HIV-1. Una combinazione di questi metodi biofisici con gli esperimenti sull'attività enzimatica e la creazione di forme mutanti di A3G da parte del laboratorio Chelico ha permesso a Williams e Morse di confrontare la forma originale della proteina con diversi mutanti contenenti cambiamenti strutturali. Ciò ha consentito l'isolamento del processo che ha portato alla proteina dimerizzata legata in modo stabile.
Negli ultimi 12 anni, il laboratorio Williams ha studiato la replicazione dell'HIV-1 con l'aiuto di una sovvenzione NIH. Il loro progetto più recente riguarda la comprensione delle proteine immunitarie innate che conferiscono agli esseri umani l'immunità all'HIV-1. Ci sono sette proteine nella famiglia APOBEC3, alcuni dei quali combattono contro i retrovirus come l'HIV-1, mentre altri combattono contro i retrotrasposoni, che sono elementi genetici che si amplificano all'interno di un genoma e hanno il potenziale per causare malattie.
Tutte le proteine APOBEC sono citidina deaminasi, permettendo loro di modificare il DNA a singolo filamento per sostituire le basi, causando mutazioni quando il filamento viene replicato. Però, A3G ha anche un'altra funzione che fa esattamente il contrario. Piuttosto che sfrecciare rapidamente lungo il genoma apportando modifiche, può diventare una proteina legante stabile che inibisce il processo di trascrizione inversa, prevenire la replicazione dell'HIV-1. Ciò accade a causa di un processo chiamato oligomerizzazione, dove singole unità proteiche (monomeri) si uniscono per creare complessi multiproteici o oligomeri.
"L'idea che tu possa zoomare e apportare queste modifiche, e tuttavia anche impedire a qualcos'altro di muoversi, non aveva davvero senso, " ha detto Williams. "Ecco perché l'oligomerizzazione è così importante. Mentre iniziano velocemente e vanno avanti, col tempo si oligomerizzano e diventano molto lenti."
Questo team di ricercatori ha scoperto l'oligomerizzazione come pubblicato nel loro articolo del 2014 in Chimica della natura . Il loro studio ha dimostrato che la crescita di un complesso multiproteico ha causato il rallentamento della proteina, ma non si sapeva quante proteine fossero necessarie per formare un complesso lento. Se il numero era alto, i risultati potrebbero non essere rilevanti per la replicazione virale. Inoltre, potevano mostrare che i complessi erano lenti, ma non potevano dire se i complessi lenti avevano attività enzimatica. Ma ora la loro nuova ricerca ha trovato le risposte a queste due domande critiche.
"Tra i nostri esperimenti in cui abbiamo osservato direttamente il legame delle proteine sul DNA, e il lavoro del professor Chelico sull'attività enzimatica di A3G, abbiamo scoperto che su scale temporali brevi nella forma monomerica, la proteina si lega e si dissocia molto rapidamente dal DNA e ha un'elevata attività enzimatica, " disse Morse. "Ma una volta che lasci che si formino questi oligomeri, il legame è molto più stabile, e non si dissocia facilmente. Il professor Chelico è stato in grado di scoprire che l'attività enzimatica in realtà diminuisce quando si verifica questo processo, quindi si hanno queste due funzioni:l'attività enzimatica che si verifica su una scala una tantum, e in una forma, e questa funzione secondaria che, a causa dell'oligomerizzazione, si verifica in un altro lasso di tempo."
La loro ricerca ha mostrato che questo accade anche se solo due proteine si uniscono, formando un dimero. Il dimero è sufficiente per rendere stabile il complesso proteico e alterare la funzione della proteina. Poiché è necessario solo un dimero, più blocchi stradali potrebbero agire per impedire il verificarsi della trascrizione inversa. Ora, questa importante funzione è più probabile che sia biologicamente rilevante.
"Sapere come qualcosa inibisce l'HIV-1 potrebbe essere una guida per aiutare a progettare nuovi metodi per i farmaci anti-HIV. Il virus HIV-1 ha sviluppato una propria proteina per indurre la cellula a degradare le proteine APOBEC, quindi se riusciamo a capire come fermare quel degrado, forse potremmo aumentare la capacità di questa proteina di inibire l'HIV-1, " ha detto Williams.
Il Williams Lab della Northeastern University intende continuare a studiare le diverse proteine APOBEC, altri dei quali inibiscono l'HIV-1 o i retrotrasposoni. Attraverso lo studio di queste proteine con i loro strumenti di misurazione biofisici unici, il loro laboratorio spera di capire la regolazione delle proteine, attività, e processi per aiutarci a essere ulteriormente preparati contro l'HIV e altre malattie correlate.