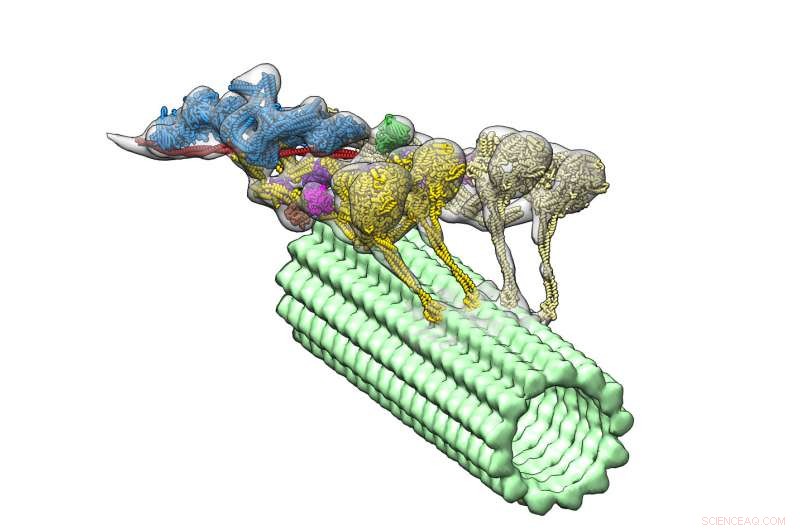
Il complesso dineina-dinactina (multicolore) si muove lungo un microtubulo (verde). I quattro domini motori sono mostrati in giallo. Dynactin (blu) fornisce l'impalcatura per tenere insieme le due dineine. Credito:Danielle Grotjohn, Lander Lab
Sull'autostrada cellulare, le proteine motorie chiamate dineine dominano la strada. Le dineine "camminano" lungo strutture chiamate microtubuli per trasportare il carico cellulare, come molecole di segnalazione e organelli, alle diverse parti di una cellula. Senza dynein sul lavoro, le cellule non possono dividersi e le persone possono sviluppare malattie neurologiche.
Ora un nuovo studio, che appare sul giornale Biologia strutturale e molecolare della natura , fornisce la prima visualizzazione tridimensionale (3D) del complesso dineina-dinactina legato ai microtubuli. I leader dello studio del The Scripps Research Institute (TSRI) riferiscono che una proteina chiamata dinactina unisce due dineine, come un giogo che tiene insieme una coppia di cavalli da tiro.
"Se vuoi che una squadra di cavalli si muova in una direzione, devi allinearli, " dice Gabriel C. Lander, dottorato di ricerca, un professore associato TSRI e autore senior dello studio. "Questo è esattamente ciò che la dinactina sta facendo alle molecole di dineina".
Comprendere come il complesso dineina-dinactina è assemblato e organizzato fornisce una base fondamentale per spiegare le cause alla base di diverse malattie neurodegenerative legate alla dineina come l'atrofia muscolare spinale (SMA) e la malattia di Charcot-Marie-Tooth (CMT).
I ricercatori sapevano che la dinattina è necessaria per la dineina per spostare il carico, ma hanno lottato per ottenere un quadro completo di come le diverse parti del complesso lavorassero insieme.
"Sapevamo che la dineina diventa attiva solo quando si lega con un partner chiamato dinactina. Il problema era che, storicamente, è stato difficile risolvere questa struttura perché è molto flessibile e dinamica, " spiega Danielle Grotjahn, uno studente laureato TSRI e co-primo autore dello studio. "Avevamo bisogno di visualizzare questi complessi dineina-dinactina per capire fondamentalmente come funziona per trasportare le molecole".
Per il nuovo studio, i ricercatori hanno utilizzato una tecnica di imaging chiamata tomografia crioelettronica, che è simile all'acquisizione di una TAC di una proteina, per produrre una ricostruzione 3D, o tomogramma. Per aumentare la risoluzione e la chiarezza di questi tomogrammi, i ricercatori hanno utilizzato algoritmi computazionali avanzati per fare la media insieme di molti singoli complessi proteici.
In questo caso, però, gli attuali metodi di elaborazione non sono stati in grado di produrre un chiaro, struttura 3D interpretabile del complesso dineina-dinactina estremamente flessibile.
Grotjahn sapeva che le informazioni necessarie erano nascoste nei tomogrammi, così ha sviluppato una nuova strategia per identificare componenti specifici del complesso dineina-dinactina. Questo approccio ha aiutato a guidare il software di elaborazione delle immagini per ricostruire l'intero complesso motorio legato ai microtubuli.
"Danielle stava facendo il primo grande passo per gli algoritmi di calcolo, "dice Lander.
Con il loro nuovo, struttura dettagliata, i ricercatori hanno notato una caratteristica sorprendente:il complesso ha due molecole di dineina dove si aspettavano di vederne solo una. Ciò significa che ogni dineina ha due domini motori, il complesso dineina-dinactina ha in totale quattro domini motori.
"Questa scoperta è stata del tutto inaspettata, e cambierà il modo in cui questo complesso motorio è rappresentato nei libri di testo di biologia cellulare e biochimica, "dice Saikat Chowdhury, dottorato di ricerca, un ricercatore associato TSRI e co-primo autore dello studio.
"Ci sono stati anni di esperimenti biofisici ed esperimenti biochimici, e si è sempre pensato che ci fosse solo una molecola di dineina, " aggiunge Lander.
I ricercatori hanno anche potuto vedere dove si inserisce la dinactina. Hanno scoperto che la molecola fornisce un'impalcatura stabile, unendo insieme il gruppo dei domini motori e attivando la loro capacità di muoversi lungo i microtubuli. Questa scoperta aiuta a spiegare come il dynein può trasportare grandi carichi, come organelli che sono molto più grandi di loro stessi, su lunghe distanze in un ambiente cellulare affollato.
L'approccio di elaborazione delle immagini utilizzato in questo studio ha il potenziale per essere estremamente utile per risolvere le strutture di altri grandi, proteine flessibili.
"Ora siamo in grado di superare i modelli dei cartoni animati e visualizzare i minimi dettagli di molti complessi macromolecolari dinamici, " dice Grotjahn. "Man mano che impariamo di più sull'organizzazione 3D e sull'architettura di queste macchine molecolari, saremo meglio attrezzati per capire come funzionano male nelle malattie".
Ulteriori autori dello studio, "La tomografia crioelettronica rivela che la dinactina recluta una squadra di dineine per la motilità progressiva, erano Yiru Xu dello Scripps Research Institute; Richard J. McKenney dell'Università della California, Davis; e Trina A. Schroer della Johns Hopkins University.