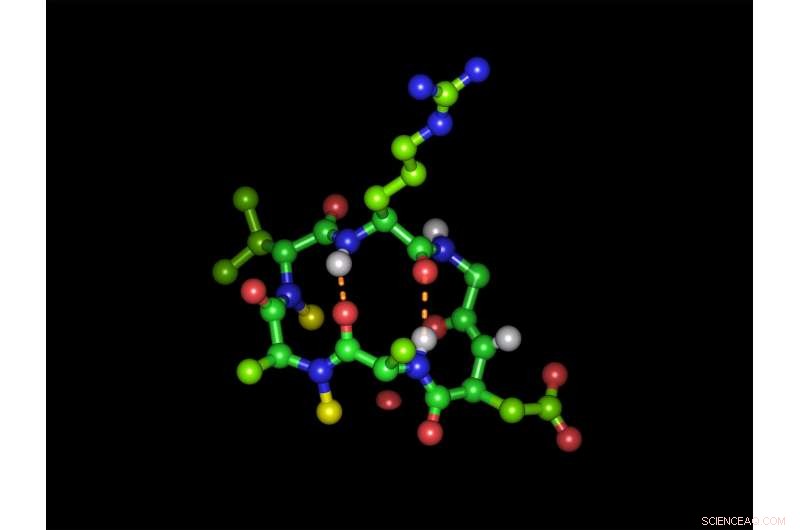
Esapeptide ciclico nella sua forma bioattiva con la sequenza tripeptide che lega l'integrina arginina-glicina-acido aspartico:le sfere verdi rappresentano atomi di carbonio, atomi di ossigeno rosso, atomi di azoto blu e atomi di idrogeno bianco. Le sfere gialle rappresentano i due gruppi N-metilici e le linee arancioni tratteggiate mostrano i due legami idrogeno intramolecolari. Disposizione (in senso orario):arginina (in alto), glicina, acido aspartico, alanina, alanina N-metilata, D-valina N-metilata. Attestazione:Michael Weinmueller / TUM
peptidi, brevi catene di aminoacidi che controllano molte funzioni nel corpo umano, rappresentano un mercato da miliardi di dollari. Ma normalmente, devono essere iniettati farmaci a base di peptidi. Un team di ricerca guidato dall'Università tecnica di Monaco (TUM) ha ora determinato come i peptidi possono essere progettati per la somministrazione come liquido o compressa.
I peptidi sono brevi catene di amminoacidi. Nel corpo umano, controllano diverse funzioni come molecole di segnalazione. Esempi ben noti includono insulina, che comprende 51 elementi costitutivi di aminoacidi e controlla il metabolismo dello zucchero, o ciclosporina, un undici aminoacidi-peptide che ha dimostrato di sopprimere il rigetto d'organo dopo i trapianti.
"I peptidi sono meravigliosamente adatti come farmaci, "dice Horst Kessler, Carl von Linde Professore all'Institute for Advanced Study della TU Munich. "Il corpo li usa già come molecole di segnalazione, e quando hanno fatto il loro lavoro, possono essere riciclati dal corpo, nessun accumulo, nessuna disintossicazione complicata."
In tutto il mondo, ci sono attualmente circa 500 farmaci a base di peptidi negli studi clinici. Una manciata di farmaci peptidici sta già ottenendo ricavi nell'ordine di miliardi. Ma il fatto che non possano essere somministrati in compresse è uno svantaggio decisivo di quasi tutte le sostanze di questa categoria. Poiché le proteine sono una parte importante della dieta, lo stomaco e l'intestino ospitano innumerevoli enzimi che rompono i legami peptidici. Nessun farmaco a base di peptidi non modificati avrebbe la possibilità di sopravvivere al passaggio attraverso il tratto gastrointestinale.
Eppure, anche quando i composti peptidici opportunamente modificati riescono ad attraversare lo stomaco intatto, un altro ostacolo li attende:le cellule delle pareti intestinali impediscono il loro assorbimento nel sangue. Questo è il motivo per cui questi tipi di agenti attivi vengono generalmente somministrati solo per iniezione. Il team ha inizialmente affrontato queste sfide utilizzando un peptide modello a forma di anello. Comprendeva sei molecole del più semplice amminoacido, alanina. Gli scienziati lo hanno utilizzato per studiare quale effetto ha sulla disponibilità orale la sostituzione degli atomi di idrogeno dei legami peptidici con i gruppi metilici.
Ciò ha provocato oltre 50 variazioni. I test cellulari condotti da partner di collaborazione in Israele hanno dimostrato che solo varianti peptidiche specifiche vengono assorbite molto rapidamente. "Sembra che gli esapeptidi ciclici con una struttura specifica siano in grado di utilizzare un sistema di trasporto esistente, " afferma il Prof. Kessler. Il team ha scelto i recettori delle integrine che controllano una varietà di funzioni sulla superficie cellulare come bersaglio per i loro peptidi. Una sequenza dei tre amminoacidi arginina, la glicina e l'acido aspartico sono la chiave per l'aggancio a questi recettori. I collaboratori di Kessler hanno incorporato la sequenza chiave in diverse posizioni del loro peptide modello, creando così nuove varianti.
Però, sia la catena laterale caricata negativamente dell'acido aspartico che l'arginina caricata positivamente si sono rivelati criteri knock-out per l'utilizzo del sistema di trasporto. Il team è comunque riuscito a mascherare i gruppi carichi di entrambi gli amminoacidi con gruppi protettivi. Sebbene con questo il peptide inizialmente perde la sua capacità di legarsi alla molecola bersaglio, se vengono selezionati i gruppi di protezione corretti, vengono nuovamente scissi da enzimi che sono ubiquitari nel sangue. L'effetto farmaceutico viene così ripristinato all'arrivo a destinazione.

Coautori Dr. Florian Reichart, Dott. Andreas Räder, Michael Weinmueller e il Prof. Horst Kessler (fltr) nel laboratorio dell'Università Tecnica di Monaco. Attestazione:Uli Benz / TUM
Prova di disponibilità orale
I test cellulari hanno dimostrato che il nuovo esapeptide ha effettivamente un effetto biologico. A basse dosi stimola la crescita dei vasi sanguigni. Quando i topi vengono nutriti con l'esapeptide mascherato, l'effetto è lo stesso di quelli a cui è stato iniettato l'esapeptide non mascherato. "Nel passato, gli esperti hanno designato la disponibilità orale di farmaci a base di peptidi come il "Santo Graal della chimica dei peptidi". Il nostro lavoro fornisce una strategia per risolvere le sfide della stabilità, assorbimento nel corpo ed efficacia biologica, " dice Kessler. "In futuro, questo semplificherà notevolmente la creazione di farmaci peptidici che possono essere facilmente somministrati in forma fluida o in compresse".
La comunicazione tra le cellule di un organismo nei vari organi è un prerequisito essenziale per l'esistenza degli organismi pluricellulari. Recettori sulla superficie cellulare, le cosiddette integrine, giocare un ruolo importante qui. Trasmettono informazioni sull'ambiente di una cellula all'interno della cellula.
tumori, Per esempio, inviare segnali di crescita alle cellule dei vasi sanguigni per mantenerle in crescita e quindi garantire l'afflusso di sangue al tumore. Inoltre, le integrine malfunzionanti sono la causa di molte malattie che le rendono molto interessanti per i ricercatori farmaceutici.
Il ruolo della sequenza di riconoscimento
Delle 24 integrine umane, otto sottotipi riconoscono una piccola sequenza comprendente solo tre amminoacidi:arginina, glicina, e acido aspartico (abbreviazione:Arg-Gly-Asp, acronimo:RGD).
Questa struttura si inserisce nel recettore dell'integrina come una chiave. Le molecole segnale e le proteine che hanno questa sequenza innescano una reazione della cellula. Insieme ad altri aminoacidi che svolgono un ruolo di riconoscimento, la struttura spaziale della sequenza determina a quale delle integrine si adatta la chiave.
I ricercatori farmaceutici sono ora alla ricerca di molecole che abbiano queste sequenze di riconoscimento nella struttura spaziale adatta, permettendo loro di innescare le stesse reazioni cellulari. La capacità di mirare in modo specifico a diversi sottotipi di integrine è un passo importante verso la medicina personalizzata in cui tutti i tipi di cancro possono essere combattuti su base specifica del paziente.