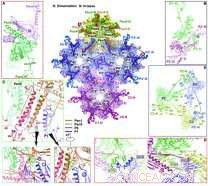
Panoramica delle interazioni sulla superficie interna del capside. Attestazione:WANG Xiangxi
L'herpesvirus è geneticamente e strutturalmente uno dei virus più complessi. Si diffonde all'interno della popolazione ospitante in modo efficiente, causando una serie di malattie negli esseri umani, compresi i disturbi congeniti e i tumori.
La via di assemblaggio dell'herpesvirus produce tre tipi distinti di capsidi chiamati A-, Capsidi B e C, rispettivamente. I tre tipi di capside hanno tutti gusci angolari maturi e un meccanismo di assemblaggio simile. Però, si sa poco della struttura e del meccanismo di assemblaggio del capside del virus dell'herpes simplex (HSV).
Utilizzando una combinazione di ricostruzione "basata su blocchi" e accurate correzioni della sfera di Ewald, Prof. WANG Xiangxi, Prof. RAO Zihe e Prof. ZHANG Xinzheng presso l'Istituto di Biofisica dell'Accademia Cinese delle Scienze, insieme ai colleghi della Hunan Normal University, e gli Istituti nazionali per il controllo degli alimenti e dei farmaci, ricostruito la struttura 3.1 del virus herpes simplex di tipo 2 (HSV-2) B-capside e costruito il modello atomico, ampliando così la comprensione del meccanismo di assemblaggio del capside. Questo studio è stato pubblicato in Scienza .
Essendo uno dei quattro principali strati strutturali, il capside 125 nm dell'herpesvirus non solo protegge il genoma virale da danni meccanici e di altro tipo, ma funziona anche per rilasciare il genoma virale nel nucleo della cellula ospite durante l'infezione iniziale e per impacchettare il genoma durante la maturazione.
I ricercatori hanno scoperto che ci sono quattro principali conformatori della principale proteina del capside VP5, che mostra notevoli differenze nella configurazione e nella modalità di assemblaggio per formare estese reti intermolecolari.
Il triplete, un assemblaggio eterotrimerico che si inserisce tra esameri e pentameri in posizioni quasi tre volte per cementare insieme il capside, è costituito da due copie di VP23, ognuno esibendo conformazioni notevolmente diverse, e una copia di VP19C. Sei copie della piccola proteina del capside VP26 formano un anello sulla sommità dell'esone e stabilizzano ulteriormente il capside.
Sulla base della struttura del capside, i ricercatori hanno proposto un modello per l'assemblaggio ordinato del capside utilizzando un triplex e il suo triangolo lazo legato covalentemente formato da tre VP5. Queste unità di assemblaggio di base si raggruppano quindi in strutture di ordine superiore conformi a una doppia simmetria e guidano gli intermedi dell'assemblaggio nascente nella corretta geometria T =16, consentendo i primi passi verso la comprensione dei driver di montaggio e delle basi di stabilità del capside.