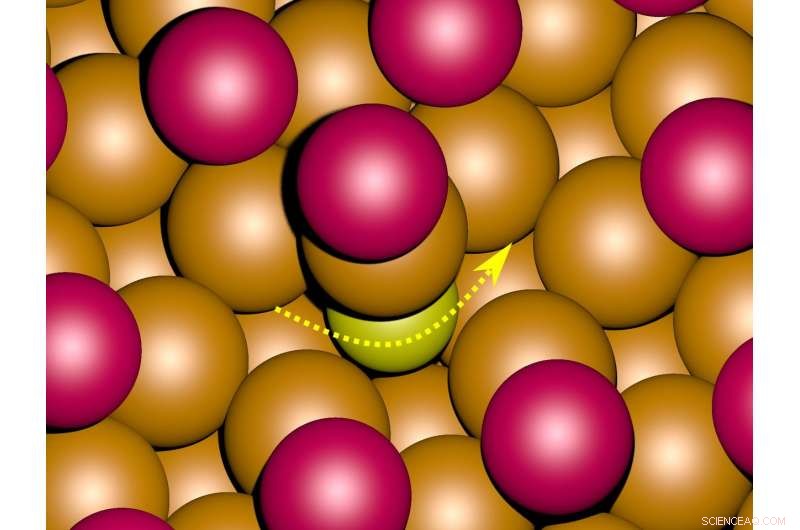
Le simulazioni al computer del movimento attraverso la superficie di un metallo (arancione) suggeriscono che in presenza di uno strato di ioni bromuro (magenta) gli atomi di zolfo (giallo) cambiano posizione immergendosi brevemente nel metallo (vedi freccia). Attestazione:Deuchler
Nelle batterie, celle a combustibile o rivestimenti tecnici, processi chimici centrali avvengono sulla superficie degli elettrodi a contatto con i liquidi. Durante questi processi, gli atomi si muovono sulla superficie, ma come questo accada esattamente è stato appena studiato. I fisici dell'Università di Kiel vogliono ottenere una migliore comprensione di questi movimenti, e il ruolo dei componenti chimici coinvolti. Fare così, osservano con la massima risoluzione microscopica come gli atomi di zolfo si muovono su elettrodi di rame, che sono immersi in diverse soluzioni saline. Le registrazioni video microscopiche hanno mostrato che questi movimenti sono controllati da ioni, attaccato alla superficie dell'elettrodo. Questi risultati potrebbero aiutare a controllare con precisione tali processi di movimento, ad esempio per ottimizzare i processi di rivestimento nell'industria della microelettronica. I risultati di questo studio sono pubblicati nell'attuale numero della rinomata rivista scientifica Angewandte Chemie .
I processi alle interfacce sono simili a una partita di calcio in uno stadio:la squadra in campo deve segnare i gol, ma probabilmente anche il sostegno degli spettatori ha un'influenza sull'andamento del gioco. "Ioni o molecole che si attaccano a una superficie, può avere un'influenza decisiva sulle reazioni che vi si verificano, anche se non direttamente coinvolti, " ha detto il professor Olaf Magnussen, capo dell'Interface Physics Group presso l'Istituto di Fisica Sperimentale e Applicata. In chimica, questi atomi sono conosciuti come "specie spettatore". Però, l'esatta influenza di tali "spettatori" atomici sulle reazioni alle interfacce è, nella maggior parte dei casi, noto solo in parte. Ulteriori conoscenze potrebbero aiutare a controllare meglio questi processi.
Nel loro esperimento, il gruppo di ricerca ha studiato elettrodi di rame in soluzioni saline, contenenti ioni cloro o bromo. Questi ioni si accumulavano come "spettatori" sulla superficie del rame. I ricercatori hanno poi aggiunto piccole quantità di atomi di zolfo, e ne osservò il moto termico sulla superficie dell'elettrodo. Fare così, hanno usato uno speciale microscopio a scansione a effetto tunnel, che può rendere visibili singoli atomi, anche in soluzioni saline. Poiché questo funziona solo a temperature sopra lo zero, gli atomi si muovono relativamente velocemente, le immagini microscopiche devono quindi essere scattate in breve tempo.

La registrazione del microscopio a effetto tunnel mostra atomi di zolfo (rosso) su un elettrodo di rame, circondato da ioni bromo (verde). Attestazione:Rahn
Nel microscopio a effetto tunnel, una piccola punta di metallo scansiona l'elettrodo, e quindi crea un'immagine della sua superficie. Gli strumenti standard possono acquisire un'immagine al minuto. Nel corso di diversi anni, il gruppo di lavoro di Kiel ha ulteriormente sviluppato il microscopio in modo che il loro strumento possa generare fino a 20 immagini al secondo. Con questo strumento unico al mondo, è possibile catturare in un video come si muovono gli atomi su una superficie.
Le registrazioni risultanti hanno sorpreso il team di ricerca:in entrambe le soluzioni saline, la velocità degli atomi di zolfo era fortemente influenzata dalla tensione applicata all'elettrodo. Anche un aumento di appena 1/10 di volt li faceva muovere dieci volte più velocemente. Però, un voltaggio più alto faceva muovere più lentamente gli atomi di zolfo sulla superficie con gli ioni cloruro, ma più veloce sulla superficie ricoperta di bromuro. "Il cloruro e il bromuro sono chimicamente molto simili - non ci aspettavamo questo comportamento diverso, " ha detto Björn Rahn, che ha svolto queste indagini come parte della sua tesi di dottorato sotto la supervisione di Magnussen.
Gli indizi per una spiegazione di queste diverse osservazioni sono stati forniti da simulazioni al computer, prodotto dal gruppo di lavoro del Professor Eckhard Pehlke dell'Istituto di Fisica Teorica e Astrofisica. "Gli atomi di zolfo si comportano in modo così diverso su superfici con ioni cloruro e bromuro, perché i due ioni innescano diversi meccanismi di movimento, " disse Pehlke, per spiegare i calcoli della sua squadra.

Il ricercatore di dottorato Björn Rahn (a destra) dell'Interface Physics Group ha eseguito gli esperimenti con il microscopio a effetto tunnel. Lukas Deuchler, che è attualmente dottorando di ricerca in fisica teorica, simulato i processi atomici su computer ad alte prestazioni. Credito:Siekmann, CAU
Mentre gli atomi di zolfo in presenza di ioni cloruro si muovono solo sulla superficie, i calcoli per la superficie con ioni bromuro suggeriscono che gli atomi di zolfo si immergono brevemente nella superficie metallica mentre cambiano le loro posizioni.
Le simulazioni al computer confermano che gli ioni bromuro e cloruro sulla superficie sono più che semplici spettatori passivi, e invece influenzano direttamente i processi chimici. Questi risultati fondamentali della ricerca non solo aiutano a comprendere meglio i processi elementari alle interfacce. "I nostri risultati sono anche un primo passo verso un migliore controllo di tali processi elettrochimici, " disse Magnussen, guardando avanti.