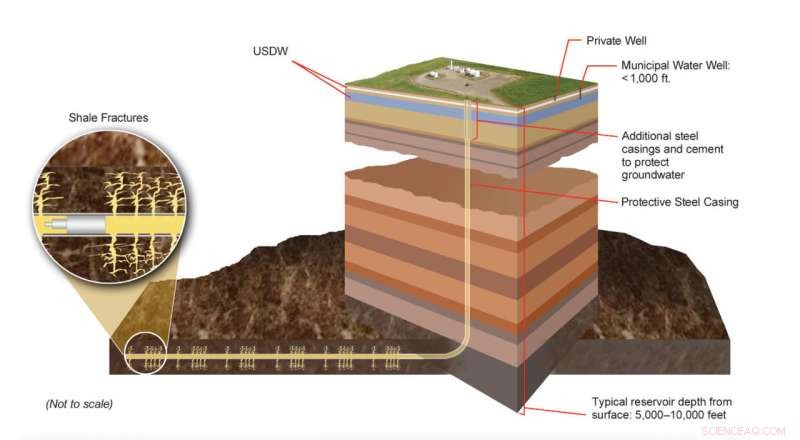
Porzioni producibili di formazioni di gas di scisto si trovano molte migliaia di piedi sotto la superficie terrestre, ben al di sotto delle sorgenti sotterranee di acqua potabile (USDW). La moderna tecnologia di fratturazione idraulica comporta sofisticati processi ingegneristici progettati per creare reti di frattura distinte in specifici strati di roccia. Gli esperti monitorano continuamente questi processi per assicurarsi che siano conformi alle normative locali, stato, e leggi e regolamenti federali. Credito:US DOE
E se un importante gas serra che intrappola il calore potesse essere consumato per produrre una sostanza chimica preziosa che scarseggia? I chimici del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) hanno identificato un catalizzatore, una sostanza che accelera una reazione chimica, che potrebbe essere in grado di fare proprio questo. Questo catalizzatore "bimetallico", in ferro e nichel, guida la reazione del gas serra biossido di carbonio e il gas propano ricco di energia per produrre propilene. Il propilene è un elemento chimico utilizzato nella produzione di molti oggetti di uso quotidiano, comprese le batterie, parti di automobili, e abbigliamento e altri prodotti tessili.
Il gap di produzione di propilene
Storicamente, il propilene è stato un sottoprodotto del cracking con vapore, un processo in cui una materia prima (materia prima) viene miscelata con vapore e riscaldata a circa 1500 gradi Fahrenheit all'interno di enormi forni che "rompono" i legami molecolari, per produrre etilene, il precursore per la maggior parte delle materie plastiche del mondo. Però, il propilene non viene più coprodotto nelle quantità necessarie per soddisfare la domanda. Nell'ultimo decennio, gas di scisto, o gas naturale da rocce sedimentarie a grana fine, è diventato molto economico negli Stati Uniti a causa dei progressi tecnologici nel fracking. Il gas di scisto consiste principalmente di metano ma contiene anche frazioni di etano e propano. L'industria ha approfittato di questa abbondanza di etano a basso costo nelle materie prime per la produzione di etilene, ma a scapito della produzione di propilene.
"La quantità di propilene coprodotto dipende dal tipo di materia prima utilizzata, e lo steam cracking dell'etano è altamente selettivo verso l'etilene, " disse Jingguang Chen, che ricopre incarichi congiunti come chimico senior presso il Brookhaven Lab e come Thayer Lindsley Professor of Chemical Engineering presso la Columbia University. "Sono necessarie tecnologie che mirano specificamente alla produzione di propilene per colmare il divario di questa importante sostanza chimica".
Una delle tecnologie esistenti è la deidrogenazione del propano, in cui due atomi di idrogeno vengono rimossi dal propano (C3H8) per produrre propilene (C3H6). Ma questo processo è molto energivoro a causa delle alte temperature richieste per ottenere notevoli rese di propilene. Sebbene l'aggiunta di ossigeno all'alimentazione di propano riduca la quantità di energia richiesta, in presenza di eccesso di ossigeno, il propano brucia per formare acqua e anidride carbonica.
Una nuova rotta per la produzione di propilene
In questo studio, gli scienziati hanno trovato un approccio più rispettoso dell'ambiente e dell'energia introducendo l'anidride carbonica come reagente, invece di un prodotto.
"L'anidride carbonica funge da ossidante, reagendo con propano per produrre propilene, acqua, e monossido di carbonio, " ha detto Elaine Gomez, un dottorato di ricerca candidato in ingegneria chimica alla Columbia University e membro del gruppo di ricerca di Chen. Gomez è il primo autore di un recente pubblicato Comunicazioni sulla natura articolo che descrive il lavoro.
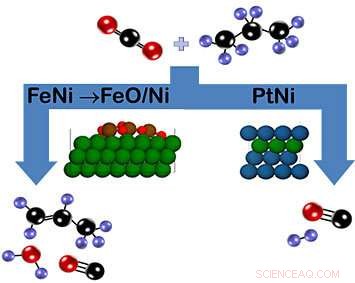
Come mostrato nello schema, anidride carbonica e propano possono reagire sul catalizzatore di ferro-nichel (FeNi) per formare propilene (a sinistra) o sul catalizzatore di platino-nichel (PtNi) per formare syngas (a destra). Nel caso di FeNi, uno strato di ossido di FeO/Ni che si forma durante la reazione favorisce la rottura del legame CH. Al contrario, il catalizzatore PtNi non ha fase ossido. Legenda colore:carbonio =nero, ossigeno =rosso, idrogeno =viola, nichel =verde, ferro =marrone, platino =blu). Credito:Brookhaven National Laboratory
Affinché questa reazione possa procedere, gli scienziati hanno dovuto progettare un catalizzatore che potesse svolgere due funzioni:attivare l'anidride carbonica (una molecola molto stabile) e rompere un legame carbonio-idrogeno (C-H).
"Il fondamento del nostro catalizzatore è ceria, o ossido di cerio, che attiva l'anidride carbonica scambiando liberamente ossigeno, " ha spiegato Gomez. "Oltre a quel supporto, aggiungiamo i metalli ferro e nichel, che può rompere il legame C-H."
Sulla base del lavoro precedente condotto dal gruppo di Chen, il team aveva un'idea su quale catalizzatore scegliere. Utilizzando risorse computazionali presso il Center for Functional Nanomaterials del Brookhaven Lab e il National Energy Research Scientific Computing Center di Lawrence Berkeley (entrambi DOE Office of Science User Facilities), Il chimico di Brookhaven Ping Liu e il ricercatore Shyam Kattel hanno calcolato la quantità di energia necessaria per far procedere i diversi passaggi della reazione catalitica. I loro calcoli si basavano su studi di spettroscopia di assorbimento dei raggi X che Gomez e i coautori Bingham Yan e Siyu Yao del dipartimento di chimica di Brookhaven hanno eseguito presso la Stanford Synchrotron Radiation Lightsource presso lo SLAC National Accelerator Laboratory e la Advanced Photon Source presso l'Argonne National Lab (anche DOE Office of Science User Facilities) per identificare la struttura e la composizione dei siti attivi del catalizzatore in condizioni di reazione. Gli spettri risultanti hanno rivelato che la superficie del catalizzatore ferro-nichel viene ossidata durante la reazione, e i calcoli hanno mostrato che questa interfaccia ossido di ferro-nichel incoraggia la rottura del legame CH.
"Un metodo computazionale chiamato teoria del funzionale della densità [DFT] ci consente di calcolare la termodinamica e la cinetica del percorso di reazione con un dato catalizzatore per determinare se la rottura del legame CH è energeticamente favorevole, " ha detto Kattel. "DFT prevede che il catalizzatore a base di ferro e nichel è un buon candidato."
Gomez ha confermato questa previsione attraverso studi sui reattori a flusso, in cui i diversi gas reagenti vengono alimentati dai serbatoi di stoccaggio in un'unica linea collegata ad un reattore a tubi di vetro a forma di U. La miscela di gas scorre in un'estremità del tubo e reagisce con il catalizzatore in polvere (alla temperatura il catalizzatore è attivo, in questo caso, circa 1000 gradi Fahrenheit) confezionati nell'altra estremità del tubo. Man mano che i prodotti emergono, una tecnica di separazione chiamata gascromatografia può essere utilizzata per identificare il tipo e le quantità di sostanze chimiche presenti. Confrontando le quantità di reagenti consumati e prodotti realizzati, gli scienziati possono determinare la selettività del catalizzatore verso il prodotto desiderato. In questo esperimento, la selettività era superiore al 50 percento per la conversione del propano in propilene.
Utilizzando lo stesso supporto di ceria ma sostituendo il ferro con il platino, gli scienziati hanno promosso un diverso percorso di reazione in cui i legami carbonio-carbonio vengono rotti per produrre monossido di carbonio e idrogeno, una combinazione nota come gas di sintesi (syngas), un intermedio per la produzione di ammoniaca, metanolo, e altri prodotti chimici.
"Entrambi i catalizzatori sono attivi alla stessa temperatura, ma sintonizzando la loro composizione chimica, possiamo guidare la reazione per produrre propilene o syngas, " disse Chen.
"Abbiamo in programma di utilizzare la nostra attuale conoscenza approfondita del meccanismo di reazione per migliorare ulteriormente la conversione del propano in propilene, " ha detto Liu. "Questa comprensione consente lo screening razionale dei catalizzatori a livello teorico, e i candidati promettenti saranno sintetizzati e testati sperimentalmente".
"Speriamo che l'industria e il mondo accademico considerino la nostra nuova rotta, che consuma un gas serra e richiede meno energia rispetto ai metodi tradizionali di produzione del propilene, " ha detto Gomez. "Tradurre la nostra scoperta in una tecnologia commercializzata potrebbe aiutare a soddisfare la domanda globale di questa sostanza chimica di alto valore".