
L'esperimento è stato eseguito presso lo strumento Coherent X-ray Imaging (CXI), che si avvale del rapido, brillanti impulsi di raggi X dalla sorgente di luce coerente Linac. CXI applica il metodo "diffrazione prima della distruzione" per eseguire misurazioni con impulsi a raggi X ultracorti prima che danneggino i loro obiettivi. Credito:SLAC National Accelerator Laboratory
Tubercolosi, una malattia polmonare che si diffonde nell'aria attraverso la tosse o gli starnuti, ora uccide più persone in tutto il mondo di qualsiasi altro agente infettivo, secondo l'ultimo rapporto globale sulla tubercolosi dell'Organizzazione mondiale della sanità. E in centinaia di migliaia di casi ogni anno, il trattamento fallisce perché i batteri che causano la Tb sono diventati resistenti agli antibiotici.
Ora un team internazionale di ricercatori ha trovato un nuovo modo per studiare come i batteri della Tb inattivano un'importante famiglia di antibiotici:hanno osservato il processo in azione per la prima volta utilizzando un laser a raggi X a elettroni liberi, o XFEL.
In esperimenti presso il Laboratorio Nazionale Acceleratore SLAC del Dipartimento di Energia, hanno mescolato un antibiotico con un enzima chiamato beta-lattamasi che usano i batteri della Tb, e poi guardava in tempo reale come l'enzima attaccava l'antibiotico per disattivarlo.
Il metodo dei ricercatori, chiamato cristallografia seriale mix-and-inject, sfrutta il brillante, impulsi ultraveloci prodotti dalla Linac Coherent Light Source (LCLS) di SLAC. Le istantanee a raggi X scattate da 30 millisecondi a 2 secondi dopo l'inizio della reazione hanno mostrato che la lattamasi si lega all'antibiotico, ceftriaxone, e rompendo uno dei suoi legami chimici.
I risultati dell'esperimento sono stati pubblicati oggi in Biologia BMC .
"Questo studio dimostrativo dimostra che siamo in grado di vedere la forma e le fasi intermedie delle molecole durante il processo, "dice Marius Schmidt, un professore dell'Università del Wisconsin Milwaukee che ha guidato l'esperimento. "Dopo decenni di tentativi di altre tecniche nel campo della cristallografia, la tecnologia è qui".
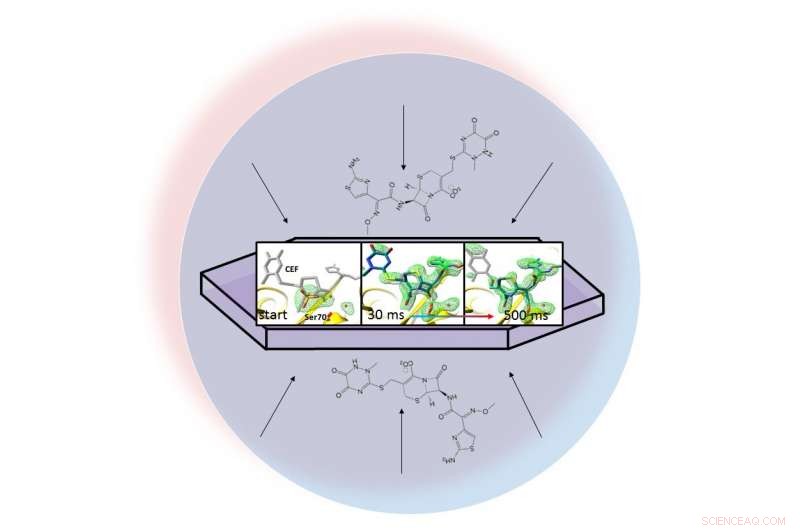
In una gocciolina liquida (rappresentata dal cerchio azzurro), un antibiotico si disperde attraverso una proteina cristallizzata, beta-lattamasi, e si lega ad esso. Le istantanee a raggi X della coppia legata hanno permesso ai ricercatori di creare mappe della densità elettronica (verde) e osservare un anello nell'antibiotico rompersi (estrema destra) da 30 a 500 millisecondi dopo l'inizio della reazione. Credito:Marius Schmidt / Università del Wisconsin Milwaukee
Nella cristallografia, gli scienziati formano un cristallo da molte copie di una proteina e colpiscono il cristallo con i raggi X per produrre uno schema di diffrazione su un rivelatore, che rivela la struttura atomica della proteina. Questa struttura è la chiave per capire come funzionano gli enzimi e altre proteine.
In passato funzionava solo con cristalli relativamente grandi, che hanno un valore limitato in questo metodo perché la soluzione contenente l'antibiotico impiegherebbe molto tempo a diffondersi nel cristallo e reagire con l'enzima. È importante che la diffusione sia più veloce della reazione, in modo che le molte molecole proteiche nel cristallo inizino insieme il processo chimico.
Ma LCLS e altri XFEL hanno fasci così intensi che possono catturare modelli di diffrazione da cristalli molto più piccoli, un milionesimo di metro di diametro o meno, Schmidt ha detto, così l'antibiotico può raggiungere rapidamente l'enzima, e la reazione può essere registrata con i raggi X.
"Mentre ci sono stati studi eleganti per osservare i movimenti delle proteine con i cambiamenti indotti dalla luce, il nostro lavoro illustra che una classe più ampia di proteine, vale a dire enzimi, può essere investigato in modo risolto nel tempo a LCLS e altri XFEL, "dice José Olmos, uno studente di dottorato alla Rice University che è uno dei principali autori della pubblicazione.
In questo studio, il team di ricerca ha prodotto minuscoli cristalli di beta-lattamasi mescolandoli con l'antibiotico solo poche frazioni di secondo prima che venissero colpiti da impulsi a raggi X.
Credito:CC0 Dominio Pubblico
Il team ha scattato milioni di istantanee a raggi X durante la reazione e le ha unite per creare una mappa che mostra i cambiamenti nella struttura tridimensionale dell'antibiotico mentre interagisce con l'enzima a temperatura ambiente.
"Per i biologi strutturali, è così che impariamo esattamente come funziona la biologia, "dice Mark Hunter, scienziato dello staff dello SLAC e coautore dello studio. "Decififichiamo la struttura di una molecola ad un certo punto nel tempo, e ci dà un'idea migliore di come funziona la molecola".
In esperimenti futuri, scattare ancora più istantanee durante il corso della reazione potrebbe fornire maggiori dettagli sulla struttura e sul comportamento chimico della lattamasi. Con più informazioni gli scienziati potrebbero manipolare la progettazione degli antibiotici per prevenire tali attacchi. Il metodo sperimentale potrebbe essere applicato anche per apprendere i dettagli fini di altri tipi di processi biologici in cui gli enzimi avviano o guidano le reazioni.
"C'è una grande quantità di entusiasmo su questo metodo, perché apre questo nuovo regno temporale ai biologi strutturali, " Hunter dice. Il lavoro precedente che utilizzava questa tecnica ha catturato l'attivazione di un interruttore dell'RNA, " importante per gli studi sui retrovirus e sul cancro.
Gli scienziati prevedono di utilizzare il metodo per esaminare ulteriori antibiotici. Intendono inoltre trarre vantaggio da tassi di ripetizione più elevati – un'attivazione più rapida degli impulsi a raggi X – prevista in un futuro aggiornamento a LCLS e all'XFEL europeo di recente apertura. Ciò consentirà agli scienziati di acquisire i dati di cui hanno bisogno in pochi minuti, rispetto ai giorni. Potrebbero anche scattare istantanee più ravvicinate delle reazioni, che potrebbe dare un quadro ancora più completo della rapida chimica mentre accade.