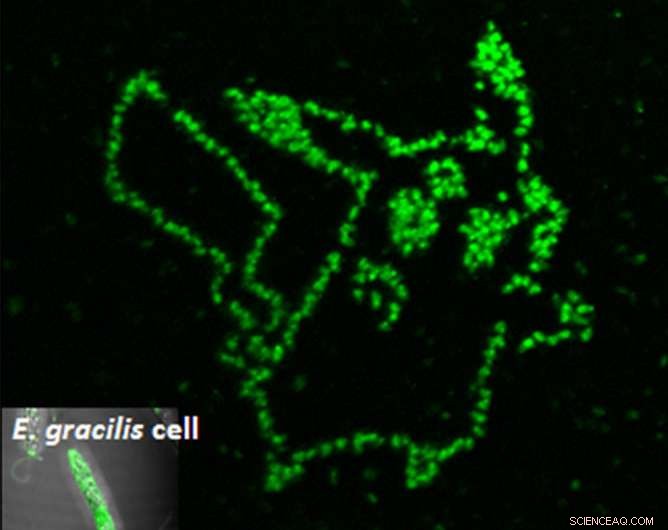
La fotoporazione di un aptamero fluorogenico in singole cellule di microalghe mostra esattamente dove si trova il metabolita desiderato. Attestazione:Yoichiroh Hosokawa
Alla ricerca di nuove fonti di materiali di consumo, gli scienziati si sono resi conto che la vita stessa potrebbe essere la soluzione. Gli ingegneri metabolici hanno alterato il metabolismo degli organismi viventi per produrre nuovi farmaci, biodegradabili e biocarburanti. Uno dei migliori esempi nei tempi moderni è la penicillina. I batteri di ingegneria metabolica hanno migliorato il tasso di produzione di questo farmaco più di 100 volte.
Una delle principali sfide in questo campo è identificare quali cellule sono le più produttive. È relativamente facile studiare popolazioni di massa, che si traduce in informazioni sul metabolismo della popolazione cellulare complessiva. Però, rimane estremamente difficile identificare quali cellule nella popolazione di massa sono al di sopra del resto in termini di produzione di metaboliti e sono quindi le migliori da copiare e imitare. Questa identificazione richiede l'osservazione in tempo reale dei processi interni delle singole cellule mentre viene prodotto il metabolita. Gli scienziati del Nara Institute of Science and Technology (NAIST) segnalano un nuovo sistema che raggiunge questo obiettivo nelle cellule di microalghe. Il sistema combina aptameri fluorogenici con fotoporazione laser a femtosecondi. Lo studio è pubblicato su Rapporti scientifici .
"Le alghe hanno una serie di qualità attraenti per l'ingegneria metabolica. Primo, sono estremamente adattabili, poiché hanno la capacità di vivere in una vasta gamma di ambienti, dall'equatore ai poli e anche in acque fortemente saline o inquinate, "dice il professor Yoichiroh Hosokawa, che ha condotto lo studio.
Normalmente, gli scienziati usano la microscopia a fluorescenza per guardare all'interno di una cellula. Questa strategia prevede il collegamento di una molecola che emette fluorescenza al metabolita di interesse. Però, a causa della protezione della parete cellulare, è stato difficile introdurre molecole fluorescenti che rilevano metaboliti specifici nelle cellule di microalghe dall'esterno.
Il team di Hosokawa ha quindi sviluppato aptameri fluorescenti che emettono fluorescenza quando si legano al metabolita paramylon e metodi di produzione che possono introdurli nella cellula mediante impulsi laser.
"Abbiamo sintetizzato un aptamero peptidico che si lega al paramylon, e lo ha introdotto nelle cellule di Euglena gracilis mediante elaborazione laser a singola cellula, " ha detto il dottor Takanori Maeno, chi è stato il primo autore dello studio. "Il paramylon è prodotto solo da Euglena e funziona come la fibra. Può essere raffinato in biocarburanti, " Ha aggiunto.
Per ottenere l'aptamer all'interno della cella, gli scienziati hanno sparato alle cellule con impulsi laser lunghi solo femtosecondi. Questi impulsi hanno creato pori temporanei abbastanza grandi da consentire l'ingresso degli aptameri. Una volta dentro, le cellule diventavano verdi solo nei punti in cui gli aptameri si legavano al paramylon. Utilizzando questa tecnica, Il gruppo di Hosokawa potrebbe misurare l'accumulo di paramylon nel tempo, discriminando così le cellule efficienti dai loro vicini improduttivi.
Mentre il sistema è stato testato solo su paramylon, Hosokawa afferma che altri metaboliti saranno rilevabili con aptameri appropriati.
"Il nostro metodo fornisce informazioni spaziali e temporali sul paramylon intracellulare bersaglio, ma dovrebbe funzionare per qualsiasi tipo di metabolita in futuro. Sarà utile per selezionare celle ad alte prestazioni, " Egli ha detto.