
L'imaging al microscopio elettronico rivela la presenza di molte vescicole interconnesse, che sembrano comportarsi come portatori di collagene (indicati dalle frecce). Credito: Comunicazioni di ricerca biochimica e biofisica
I ricercatori del Tokyo Institute of Technology (Tokyo Tech) hanno identificato un enzima che controlla la quantità di collagene secernuta dalle cellule. Poiché lo squilibrio del collagene è legato a una serie di malattie umane, lo studio fornisce indizi su nuove strategie terapeutiche. Inoltre, i risultati potrebbero facilitare la produzione efficiente di collagene per il cibo, industrie cosmetiche e farmaceutiche.
Tutte le cellule producono e rilasciano proteine. Le proteine sono confezionate come "carico" in minuscoli, vescicole simili a bolle prima di essere trasportate all'esterno della cellula. Questo processo, noto come secrezione, è vitale per una crescita e uno sviluppo sani.
Sebbene molti studi abbiano dimostrato come queste vescicole, chiamati vettori COPII, gestire carichi relativamente piccoli, pochi si sono concentrati sul funzionamento di vettori insolitamente grandi noti per confezionare proteine molto grandi, come il collagene.
Ora, uno studio condotto da ricercatori tra cui Masayuki Komada, Toshiaki Fukushima e lo studente laureato Kohei Kawaguchi del Tokyo Institute of Technology hanno identificato l'USP8 come un enzima chiave coinvolto nel controllo della formazione di grandi vettori di collagene. Hanno riportato le loro scoperte sulla rivista Comunicazioni di ricerca biochimica e biofisica .
Il team ha dimostrato che "l'accensione" dell'USP8 ha inibito la formazione di grandi vettori, e quindi ridotta secrezione di collagene. Al contrario, la disattivazione di USP8 ha promosso il trasporto di collagene, che ha portato ad un aumento della secrezione di collagene. (Vedi figure 1-3.)
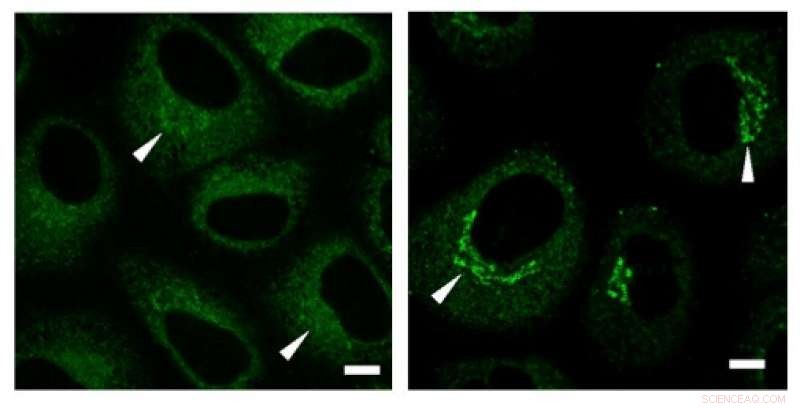
Gli esperimenti di immunocolorazione hanno rivelato un'elevata concentrazione di collagene (segnali verdi) nella regione del Golgi prima della secrezione. Credito: Comunicazioni di ricerca biochimica e biofisica
I risultati hanno grandi implicazioni per la medicina e la biotecnologia. L'eccessiva secrezione di collagene nel corpo umano è nota per causare fibrosi d'organo, mentre una secrezione di collagene insufficiente è associata a malattie ossee tra cui la displasia cranio-lenticolo-suturale (CLSD) e la sindrome di Cole-Carpenter. Nuovi trattamenti per queste malattie potrebbero essere sviluppati attraverso un'ulteriore comprensione dell'esatta modalità di azione dell'USP8. Tale conoscenza potrebbe anche fornire nuovi modi per aumentare la produzione commerciale di collagene.
I ricercatori hanno dimostrato che l'enzima agisce deubiquitinando una proteina chiamata Sec31A, un componente del rivestimento della vescicola COPII necessario per l'esportazione di proteine.
Un particolare gruppo di proteine chiamato complesso USP8-STAM1 sembra essere responsabile della deubiquitinazione di Sec31A, come illustrato in Figura 3.
Lo studio si basa su molti anni di ricerca che hanno illuminato la versatilità di USP8.
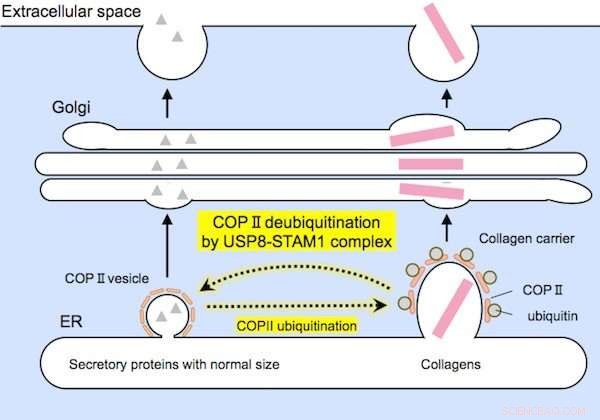
Le proteine di dimensioni relativamente piccole (a sinistra) e i collageni di grandi dimensioni (a destra) sono incapsulati da vettori COPII di dimensioni adeguate prima della secrezione. Il complesso USP8-STAM1 inibisce la formazione di grandi portatori di collagene. Credito: Comunicazioni di ricerca biochimica e biofisica
"Avevamo precedentemente riferito che USP8 regola la secrezione di ormoni ipofisari, "dice Fukushima, riferendosi a un articolo pubblicato in Genetica della natura nel 2015. "Nel processo di tale studio, abbiamo scoperto per caso che il complesso USP8-STAM1 si lega a Sec31."
Fu questa scoperta "accidentale", combinato con risultati promettenti da altri gruppi negli Stati Uniti, che ha portato il team a esaminare il ruolo dell'USP8 nella formazione dei vettori COPII.
Nella ricerca che risale a più di un decennio fa, Komada e altri hanno chiarito il ruolo convenzionale dell'USP8 nella regolazione dell'endocitosi5. "È molto interessante che lo stesso complesso USP8-STAM1 abbia ora dimostrato di svolgere un ruolo importante sia nella regolazione dell'endocitosi che nella secrezione, "Dice Fukushima.
Il presente studio rivela quindi un "nuovo volto" dell'enzima USP8, e Fukushima suggerisce che potrebbero esserci altre sorprese in arrivo. USP8 appartiene a una famiglia di circa 90 enzimi deubiquitinanti noti, che continuano ad essere un tema caldo nella biologia cellulare.