
Fig.1 Produzione di fenoli mediante batteri. Credito:Osami Shoji e Masayuki Karasawa
I ricercatori dell'Università di Nagoya usano E.coli per convertire il benzene in fenolo, semplificare una reazione chimica difficile con i metodi convenzionali
La rottura dei legami carbonio-idrogeno è notoriamente difficile nella chimica di laboratorio, eppure la natura lo fa senza sforzo. Ora, gli scienziati hanno usato i batteri E.coli per ossidare i legami C–H nel benzene per generare fenolo, con un enzima geneticamente inserito (citocromo P450BM3), che originariamente si è evoluto per colpire altre molecole, acidi grassi a catena lunga.
Far sì che gli enzimi eseguano nuove reazioni – dirottando efficacemente la biochimica delle cellule viventi per i nostri scopi – è generalmente complicato, coinvolgendo condizioni dure o modificazioni genetiche degli enzimi stessi.
Però, i ricercatori dell'Università di Nagoya hanno lavorato su questo problema utilizzando molecole "esca", che imitano i bersagli nativi (substrati) di enzimi naturali, per attivare la reazione desiderata.
Come riportato in Angewandte Chemie Edizione Internazionale , il team di ricerca ha creato un composto – soprannominato C7-Pro-Phe – a base di amminoacidi. Questa molecola esca assomiglia agli acidi grassi che E.coli metabolizza. Inserire l'esca in una cellula di E.coli, e sarà erroneamente riconosciuto come un acido grasso, innescando l'attivazione dell'enzima P450 inserito. Ora fornisci benzene (C6H6), e i batteri si danno da fare, ossidante C6H6 a C6H6O (fenolo). Non c'è bisogno del solito kit da laboratorio:le cellule viventi possono eseguire chimica complessa in modo silenzioso ed efficiente.
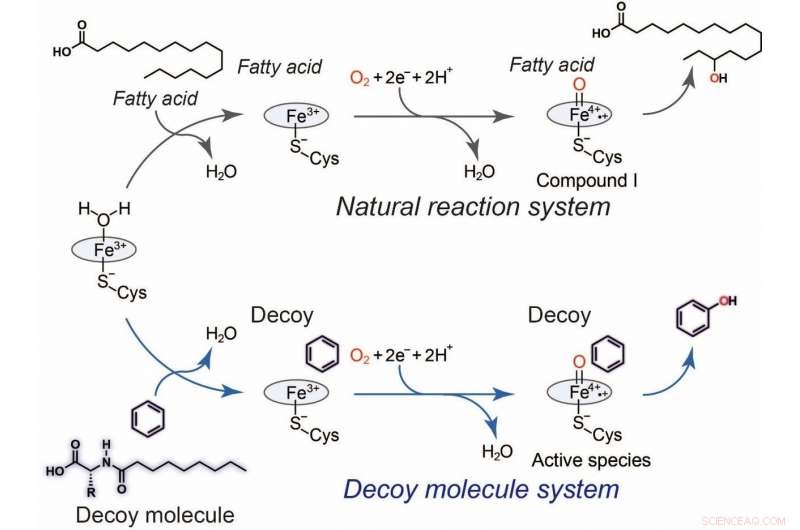
Fig.2 Idrossilazione del benzene mediante molecole esca. Ciclo catalitico generale di P450BM3 (nero) e un plausibile ciclo catalitico (blu) per l'idrossilazione del benzene catalizzata da P450BM3 con l'ausilio della molecola di richiamo. Credito:Osami Shoji e Masayuki Karasawa
"Il vantaggio del nostro sistema è che C7-Pro-Phe può essere facilmente assorbito dai batteri, dove attiva P450BM3 nella cella. Questo trasforma efficacemente ogni batterio in un biocatalizzatore a cellule intere, ", afferma il primo autore dello studio Masayuki Karasawa. "La cellula è un ambiente ottimale per la reazione biochimica. Le esche in realtà rimodellano il sito attivo dell'enzima, dandoci il controllo su aspetti della reazione, come la stereoselettività".
Tutto ciò che serve è una pronta fornitura di glucosio – che può essere riciclato dai prodotti di scarto – per alimentare l'E.coli.
Poiché una variante naturale dell'enzima, piuttosto che geneticamente modificata, è espressa dall'E.coli, è probabile che anche altri batteri possano essere modificati con lo stesso gene per svolgere questo lavoro. Inoltre, diversi esche potrebbero essere adatti a diversi substrati o batteri. "Un programma combinato di screening dell'esca e mutagenesi potrebbe creare un kit di strumenti versatile per le reazioni delle cellule intere utilizzando batteri, ", afferma il co-autore Osami Shoji.