
I progetti al computer (verde lime) vengono confrontati con strutture sperimentali (viola) a livello atomico, rivelando l'accuratezza atomica nella struttura complessiva (a sinistra) e nelle regioni del ciclo (a destra). Credito:Weizmann Institute of Science
L'idea di proteine che possono essere progettate su computer per funzioni specifiche è stato un concetto all'avanguardia che è rimasto ostinatamente "nel futuro". Una nuova ricerca presso il Weizmann Institute of Science potrebbe avvicinare un po' quel futuro. Tornando al tavolo da disegno della natura - l'evoluzione - gli scienziati hanno creato nuove proteine, basato su "parti naturali esistenti, " che svolgono la loro funzione prevista a pieni voti. Questi risultati sono stati riportati nel Atti dell'Accademia Nazionale delle Scienze ( PNAS ).
La ricerca è stata condotta dal Dr. Sarel Fleishman e dai membri del suo gruppo presso il Dipartimento di Scienze Biomolecolari, compresi gli studenti di ricerca Dror Baran, Maria Gabriele Pszolla, e Gedeone Lapidoth. Nel laboratorio del dottor Fleishman, le proteine sono progettate con programmi basati su computer che consentono loro di generare nuove strutture, ad esempio anticorpi o enzimi – che non esistono in natura. Se il team desidera una proteina che esegua un'azione specifica, diciamo, si legano a un'altra proteina o eseguono una reazione chimica:possono calcolare, dall'inizio alla fine, la sequenza genetica che allineerà gli amminoacidi nell'ordine corretto e farà piegare la proteina nella corretta forma tridimensionale. Tali proteine potrebbero, in teoria, inaugurare una nuova era di farmaci e catalizzatori progettati su misura, ma le sfide della pianificazione di grandi molecole biologiche sono immense.
Il team ha posto alcune semplici domande:"Cosa ha un enzima o un anticorpo naturale che le proteine artificiali non hanno? Perché due strutture con una composizione simile sono così diverse quando si tratta del modo in cui si comportano all'interno di un sistema biologico?"
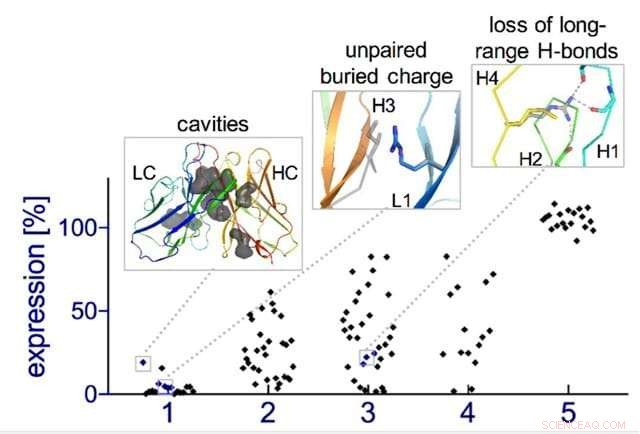
Apprendimento delle regole della progettazione degli anticorpi:i difetti negli anticorpi mirati all'insulina progettati (riquadri) vengono affrontati attraverso cinque cicli successivi di progettazione-costruzione-test dell'algoritmo "evoluzione, "aumentando la frazione di anticorpi progettati stabilmente espressi dalle cellule da quasi 0% a 100%. Credito:Weizmann Institute of Science
Il gruppo ha focalizzato la propria attenzione su alcune parti di anticorpi o enzimi naturali che partono da zero e non entrano nei progetti del computer; in particolare, strutture chiamate "loop, " che sono intrinsecamente instabili e "non ideali" e, perciò, difficile quando si tratta di previsione computazionale. Questi circuiti "non ideali" si trovano spesso proprio al centro delle regioni attive, quelle che riconoscono un bersaglio o si legano o scindono un'altra molecola.
Per incorporare questi elementi, i ricercatori hanno deciso di progettare un anticorpo funzionante da parti esistenti, piuttosto che costruirne uno da zero. Hanno rotto le strutture trovate negli anticorpi naturali in segmenti, compresi i loop e altre caratteristiche di supporto. In effetti, i ricercatori hanno armeggiato con parti già pronte, simile al modo in cui funziona l'evoluzione.
L'evoluzione naturale è, Certo, un processo molto lento:una nuova famiglia di anticorpi può richiedere decine di milioni di anni. Quindi i ricercatori sono tornati al processo di pianificazione computerizzato, questa volta armati della loro nuova intuizione. I nuovi modelli sono stati testati sperimentalmente in laboratorio, poche dozzine di nuovi anticorpi alla volta. Inizialmente, i disegni si sono comportati male, ma attraverso cinque cicli di progettazione-costruzione-test, il team ha scoperto alcune regole generali per la progettazione di anticorpi. In sostanza, hanno creato una sorta di evoluzione simbiotica – i programmi di progettazione si stavano evolvendo insieme alle prove sperimentali, ciascuno spingendo l'altro in avanti. Per dimostrare la fattibilità di questo concetto, il team ha creato anticorpi artificiali che hanno preso di mira l'insulina, caratterizzando queste molecole fino alla risoluzione dei singoli atomi.
In esperimenti futuri, gli scienziati hanno in programma di progettare anticorpi artificiali modellati su quelli di cammelli e lama. Perché questi animali particolari? Se un anticorpo umano, o uno da qualsiasi numero di animali comuni, contiene 200 aminoacidi, gli anticorpi nei cammelli e nei lama sono composti da appena 100 unità, eppure sono stabili ed efficaci. Ciò potrebbe rendere più efficiente la progettazione e la produzione di anticorpi artificiali per le condizioni umane, e potrebbe avere rilevanza per la progettazione di nuovi sistemi diagnostici e terapeutici.