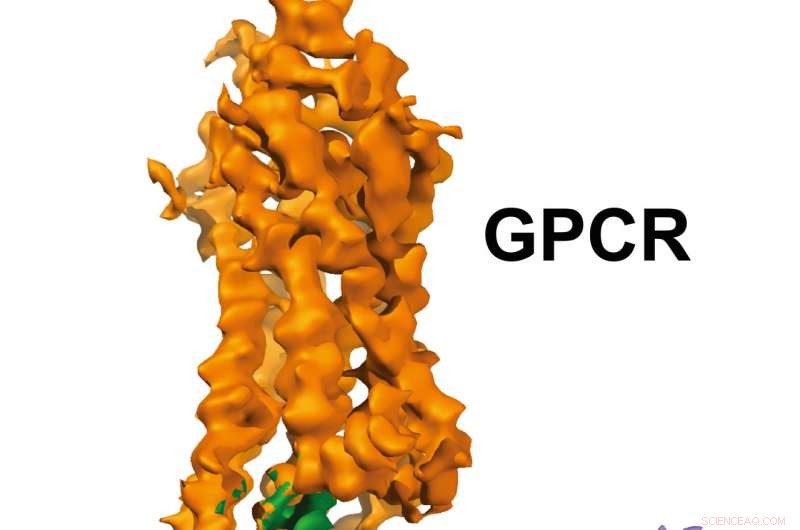
Struttura GPCR-Gi. Credito:Laboratorio Xu, Istituto di ricerca Van Andel
Per la prima volta, gli scienziati hanno visualizzato l'interazione tra due componenti critici della vasta rete di comunicazione cellulare del corpo, una scoperta che potrebbe portare a farmaci più efficaci con minori effetti collaterali per condizioni che vanno dall'emicrania al cancro.
Le immagini a risoluzione quasi atomica, pubblicato oggi in Natura , mostrano un recettore accoppiato a proteine G (GPCR) chiamato rodopsina legato a una proteina G inibitoria, e fornisce un modello per la progettazione più precisa, farmaci selettivi risolvendo anche un problema di lunga data sul campo.
"La visualizzazione di questo complesso risolve un capitolo mancante nella storia del GPCR rivelando finalmente come queste due molecole interagiscono con dettagli squisiti, " ha detto H. Eric Xu, dottorato di ricerca, un professore al Van Andel Research Institute (VARI) e uno degli autori senior dello studio. "Tutto in biologia si basa su interazioni molecolari, quindi più sappiamo come lavorano insieme le strutture di queste due molecole, la posizione migliore in cui ci troviamo per progettare farmaci migliori con meno effetti indesiderati".
Le scoperte odierne sono state rese possibili attraverso l'uso di una tecnica rivoluzionaria chiamata microscopia crioelettronica (crio-EM), che consente agli scienziati di vedere molecole difficili da visualizzare con una chiarezza sorprendente.
"L'uso della tecnologia cryo-EM per ottenere informazioni strutturali su importanti bersagli farmaceutici come i GPCR in vari stati dimostra che ora siamo in grado di applicare questi metodi per applicazioni di scoperta di farmaci, " disse Sriram Subramaniam, dottorato di ricerca, ricercatore presso il National Cancer Institute of the National Institutes of Health e autore senior dello studio.
Incorporato nella membrana cellulare, I GPCR agiscono come condotti tra una cellula e il suo ambiente, interagendo con le proteine G e altre molecole di segnalazione chiamate arrestine per trasmettere messaggi importanti da e verso la cellula che regolano una gamma di funzioni fisiologiche, compresa la crescita, risposte immunitarie e percezioni sensoriali.
Quando è collegato a GPCR, le proteine G inibitorie regolano la produzione di messaggeri chimici secondari che hanno effetti in tutto il corpo, dalle interazioni con i recettori della serotonina nel cervello e nell'intestino, che aiutano a regolare l'umore e l'appetito, alle interazioni con i recettori della dopamina nel cervello, che controllano le risposte di ricompensa e il movimento volontario, tra molti altri.
Queste interazioni ad ampio raggio con proteine G e arrestine, insieme alla loro accessibilità all'esterno della cella, rendere i GPCR bersagli attraenti per lo sviluppo terapeutico. Attualmente, oltre il 30% dei farmaci sul mercato funziona interagendo con i GPCR.
"Le informazioni rivelate dai nostri risultati aiuteranno a facilitare la progettazione di una nuova generazione di farmaci, "ha detto Yanyong Kang, dottorato di ricerca, un ricercatore nel Laboratorio Xu e co-primo autore dello studio. "Poiché questo è il primo complesso di proteine G inibitorie del GPCR ad essere determinato strutturalmente, crediamo che i nostri metodi contribuiranno a portare alla caratterizzazione di altri importanti, ma difficili da visualizzare GPCR."
Le immagini 3D generate dal team rivelano un'elica specializzata all'estremità della proteina G inibitoria che funge da firma strutturale, che aiuta i GPCR come la rodopsina a differenziare tra proteine G inibitorie e un altro tipo di proteina G nota come proteina G stimolante.
I risultati di oggi sono gli ultimi di una serie di primati per Xu e il suo team, che includono un punto di riferimento 2015 Natura studio che per primo ha descritto la struttura di rodopsina e arrestina in complesso insieme. Questo lavoro, che è stato salutato come un importante passo avanti nel campo, ha guadagnato a Xu l'Hans Neurath Award dalla The Protein Society e dalla Hans Neurath Foundation nel 2016.
In uno studio di follow-up pubblicato in Cellula nel 2017, Xu e i suoi collaboratori hanno ulteriormente perfezionato la loro precedente struttura del complesso rodopsina-arrestina, e ha rivelato una serie di codici di fosforilazione che dettano l'assemblaggio dei complessi GPCR-arrestina.
I GPCR sono notoriamente difficili da visualizzare utilizzando i tradizionali metodi di cristallografia a raggi X; ad oggi, solo 40 su più di 800 GPCR totali hanno avuto la loro struttura determinata, compreso il complesso rodopsina-arrestina di Xu.
Per determinare la struttura odierna, il team ha sfruttato il microscopio crioelettronico Titan Krios ad alta potenza di VARI, che è in grado di visualizzare molecole 1/10, 000esimo della larghezza di un capello umano e può visualizzare più facilmente molecole come i GPCR che sono incorporate nella membrana cellulare. Krios dell'Istituto, che fa parte della suite di microscopia crioelettronica avanzata David Van Andel, è uno dei meno di 120 di questi microscopi al mondo.
Subramaniam e il suo team hanno aperto la strada all'uso della crio-EM per determinare alcune delle strutture a più alta risoluzione segnalate finora utilizzando la crio-EM, inclusi diversi complessi ligando-proteina clinicamente rilevanti.