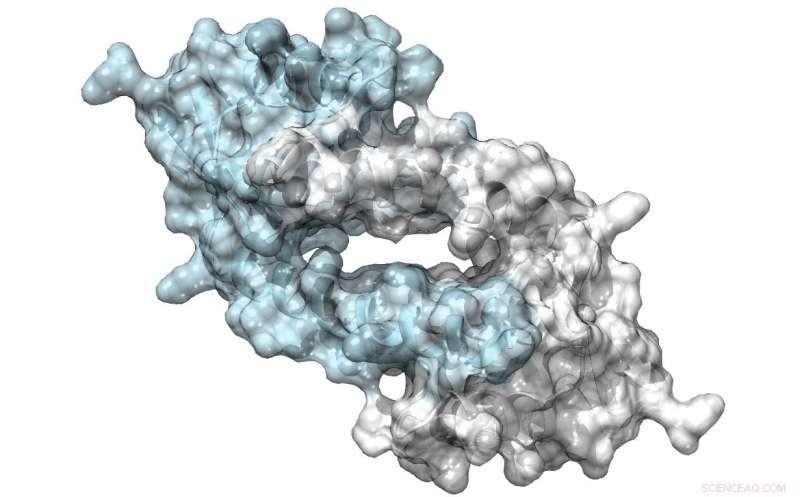
Struttura di LmrR, una proteina con un grande poro alla sua interfaccia dimero, che possono legare antibiotici o reclutare substrati per essere sottoposti a catalisi. Credito:Clemens Mayer / Università di Groningen
I chimici dell'Università di Groningen hanno creato un nuovo enzima con un amminoacido innaturale come centro attivo. Hanno creato l'enzima modificando una proteina legante l'antibiotico che normalmente agisce come fattore di trascrizione batterica. Ulteriori modifiche del sito reattivo possono creare diversi enzimi da utilizzare nella sintesi chimica. Una descrizione del nuovo enzima è stata pubblicata in Chimica della natura il 2 luglio.
L'industria chimica sta lavorando duramente per sostituire i processi convenzionali, che possono utilizzare sostanze chimiche tossiche o molta energia, con alternative più rispettose dell'ambiente. Un'alternativa popolare sono gli enzimi, che di solito funzionano in acqua a temperature moderate. Però, il numero di reazioni catalizzate da enzimi naturali è limitato rispetto a quanto disponibile in chimica. "Ecco perché la progettazione degli enzimi è davvero decollata negli ultimi anni, ", afferma Gerard Roelfes, professore di chimica biomolecolare dell'Università di Groningen.
Catalisi aumentata
Gli enzimi possono essere ingegnerizzati in diversi modi. Ancora, finora, solo i 20 amminoacidi naturali sono stati utilizzati per creare il sito attivo degli enzimi. Questo limita il numero di reazioni che questi enzimi progettati possono eseguire, sostiene Roelfes:"Pensiamo che l'incorporazione di amminoacidi non standard nelle proteine potrebbe espandere significativamente il repertorio degli enzimi di progettazione".
Il suo team ha utilizzato un fattore di trascrizione batterica come punto di partenza per il loro progetto. La proteina LmrR è un regolatore trascrizionale nel batterio Lactococcus lactis, che risponde agli antibiotici; non catalizza da solo le reazioni chimiche. È un dimero a forma di ciambella con un'apertura centrale che lega le molecole idrofobe. Utilizzando tecniche di codice genetico espanso, Roelfes ei suoi colleghi hanno introdotto l'aminoacido innaturale p-aminofenilalanina nella proteina in modo tale che l'anilina della catena laterale fosse presente nell'apertura centrale. "L'anilina è un noto catalizzatore nella sintesi chimica, ma non molto potente. Introducendolo alla proteina LmrR, aumento della catalisi di quasi tre ordini di grandezza."

Struttura proteica di LmrR il poro. Quando un amminoacido innaturale, p-amminofenilalanina, viene introdotto in questo poro, l'attività catalitica intrinseca della catena laterale dell'anilina (struttura rossa) è potenziata di quasi tre ordini di grandezza per una formazione modello di idrazone. Credito:Clemens Mayer / Università di Groningen
Diverse reattività
Il nuovo enzima lega le molecole organiche formando una struttura di idrazone, una reazione che viene utilizzata nella biotecnologia medica, Per esempio, accoppiare farmaci ad anticorpi. "Nei nostri esperimenti, abbiamo usato una reazione che dà un prodotto ben colorato, così potremmo facilmente misurare l'attività del nuovo enzima." Roelfes e il suo team stanno ora modificando l'apertura centrale per aumentare l'efficienza dell'enzima e adattarlo a reazioni specifiche.
"Ci sono molte opzioni per utilizzare questo design enzimatico nella sintesi chimica, " dice Roelfes "E potremmo anche introdurre altri amminoacidi innaturali che hanno diverse reattività." Combinando queste nuove proprietà catalitiche con il sito di legame promiscuo della proteina LmrR, Roelfes è fiducioso che si possano creare molti nuovi enzimi utili.