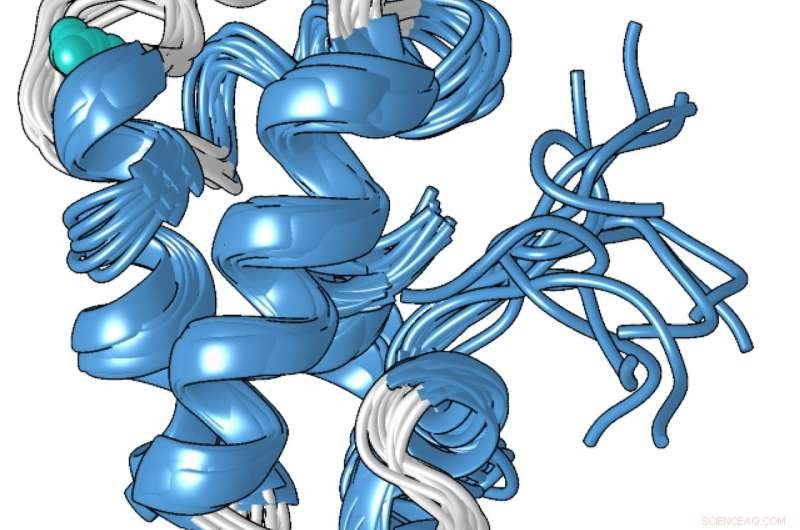
Un modello strutturale della forma compatta legata al metallo della proteina lanmodulina, che è 100 milioni di volte migliore nel legarsi ai lantanidi, i metalli delle terre rare utilizzati negli smartphone e in altre tecnologie, rispetto ad altri metalli come il calcio. Credito:Penn State
Una proteina scoperta di recente potrebbe aiutare a rilevare, obbiettivo, e raccogliere dall'ambiente i metalli delle terre rare utilizzati negli smartphone. Due nuovi studi dei ricercatori della Penn State descrivono la proteina, che è 100 milioni di volte migliore nel legarsi ai lantanidi, i metalli delle terre rare utilizzati negli smartphone e in altre tecnologie, rispetto ad altri metalli come il calcio. Il primo studio, che appare in Giornale della Società Chimica Americana , descrive la proteina, e la seconda carta, che appare online sulla rivista Biochimica , descrive la sua struttura unica, che probabilmente gioca un ruolo nella sua notevole selettività per i lantanidi.
"Recentemente, c'è stato molto interesse nell'aumentare l'accessibilità di elementi delle terre rare come i lantanidi, che vengono utilizzati negli schermi e nell'elettronica degli smartphone, batterie di auto ibride, laser, e altre tecnologie, " ha detto Joseph Cotruvo Jr., professore assistente e Louis Martarano Professore di Chimica per lo sviluppo della carriera alla Penn State e autore di entrambi gli studi. "Poiché le proprietà fisiche degli elementi delle terre rare sono così simili, può essere difficile mirare e collezionarne uno in particolare. Capire come questa proteina leghi i lantanidi con una selettività così incredibilmente alta potrebbe rivelare modi per rilevare e indirizzare questi importanti metalli".
Il team di ricerca ha scoperto la proteina, che chiamarono lanmodulina, all'interno del batterio Methylobacterium extorquens, che cresce sulle foglie delle piante e nel suolo e svolge un ruolo importante nel modo in cui il carbonio si muove attraverso l'ambiente. I batteri richiedono lantanidi per il corretto funzionamento di alcuni dei loro enzimi, compreso uno che aiuta i batteri a elaborare il carbonio, che è necessario per la sua crescita.
"Questi batteri hanno bisogno di lantanidi e altri metalli come il calcio per crescere, " ha detto Cotruvo. "Hanno bisogno di un modo per ottenere ogni metallo dall'ambiente e assicurarsi che ognuno vada nel posto giusto all'interno della cellula. Sembra che questi batteri abbiano sviluppato un modo unico per colpire i lantanidi nell'ambiente, dove sono molto meno abbondanti di altri metalli come il calcio."
La struttura unica della proteina, che Cotruvo ha determinato in collaborazione con il laboratorio di Scott Showalter, professore associato di chimica alla Penn State, può spiegare perché è 100 milioni di volte migliore nel legare i lantanidi al calcio. In assenza di metallo, Cotruvo ha spiegato, la proteina è per lo più non strutturata, ma quando il metallo è presente, cambia conformazione in un compatto, struttura ben definita.
La nuova forma compatta contiene quattro strutture chiamate "mani EF". Le cellule umane contengono molte proteine con le mani EF, che sono coinvolti nell'uso del calcio per funzioni come l'attivazione dei neuroni e la contrazione dei muscoli. Queste proteine legano anche i lantanidi, anche se i lantanidi non sono fisiologicamente rilevanti negli esseri umani e le proteine hanno solo 10 o 100 volte più probabilità di legare i lantanidi di quanto non lo siano per il calcio. La struttura compatta della proteina lanmodulina contiene anche un amminoacido chiamato prolina in una posizione unica in ciascuna delle mani EF, che possono contribuire alla selettività dei lantanidi della proteina.
"Il meccanismo della selettività di lanmodulina per i lantanidi non è ancora chiaro, ma pensiamo che dipenda dal cambiamento strutturale che avviene in presenza di metalli, " ha detto Cotruvo. "Questo cambiamento strutturale è importante per la funzione della proteina; Per esempio, alcune interazioni proteina-proteina potrebbero verificarsi solo quando la proteina è nella sua forma compatta. È necessaria una quantità molto piccola di lantanidi per indurre il cambiamento conformazionale, ma ci vorrebbe molto più calcio, più di quanto possano avere i batteri, per indurre effettivamente il cambiamento. Ciò contribuirebbe a garantire la selettività per i lantanidi all'interno delle cellule".
Comprendere come la proteina sia così selettiva può fornire spunti per la raccolta di lantanidi per scopi industriali, compresa l'estrazione da flussi di rifiuti minerari.
"Elaborare questi flussi per separare gli elementi delle terre rare da altri metalli in modo economico è impegnativo, " disse Cotruvo, “sia per la scarsa abbondanza delle terre rare sia per la loro insolubilità, richiedono grandi quantità di acido per mantenerli in soluzione. Abbassare il pH riduce tipicamente l'affinità verso i metalli, ma pensiamo che questa proteina inizi con un'affinità così elevata che potrebbe aiutare a superare queste sfide. Al momento stiamo valutando questa possibilità".
Oltre a esplorare il meccanismo di selettività della proteina e la funzione degli amminoacidi localizzati in modo univoco, il team di ricerca sta anche esplorando l'affinità della proteina per altri metalli, perché i lantanidi si trovano spesso in presenza di altri metalli, compreso il ferro, manganese, e alluminio, che si verificano in maggiore abbondanza.
"Siamo anche molto interessati alla funzione biologica della proteina, " ha detto Cotruvo. "Ma alla fine speriamo che la comprensione della proteina porti a modi più rispettosi dell'ambiente per acquisire metalli delle terre rare dall'ambiente".