Il tavolo spira di Theodor Benfey (1964). Credito:DePiep/Wikipedia
La tavola periodica guarda giù dalle pareti di quasi tutti i laboratori di chimica. Il merito della sua creazione va generalmente a Dimitri Mendeleev, un chimico russo che nel 1869 trascriveva su cartoncini gli elementi conosciuti (di cui all'epoca erano 63) e poi li disponeva in colonne e righe secondo le loro proprietà chimiche e fisiche. Per celebrare il 150° anniversario di questo momento cruciale per la scienza, l'ONU ha proclamato il 2019 Anno internazionale della tavola periodica.
Ma la tavola periodica in realtà non è iniziata con Mendeleev. Molti avevano armeggiato con la disposizione degli elementi. Decenni prima, il chimico John Dalton ha provato a creare una tabella e alcuni simboli piuttosto interessanti per gli elementi (non hanno preso piede). E solo pochi anni prima che Mendeleev si sedesse con il suo mazzo di carte fatto in casa, John Newlands ha anche creato una tabella ordinando gli elementi in base alle loro proprietà.
Il genio di Mendeleev era in ciò che lasciava fuori dal suo tavolo. Riconobbe che mancavano alcuni elementi, ancora da scoprire. Allora, dove Dalton, Newlands e altri avevano esposto ciò che era noto, Mendeleev ha lasciato spazio all'ignoto. Ancora più sorprendentemente, ha predetto accuratamente le proprietà degli elementi mancanti.
Notate i punti interrogativi nella sua tabella sopra? Per esempio, accanto ad Al (alluminio) c'è spazio per un metallo sconosciuto. Mendeleev aveva predetto che avrebbe avuto una massa atomica di 68, una densità di sei grammi per centimetro cubo e un punto di fusione molto basso. Sei anni dopo Paul Émile Lecoq de Boisbaudran, gallio isolato e sicuramente si è incastrato nello spazio vuoto con una massa atomica di 69,7, una densità di 5,9 g/cm³ e un punto di fusione così basso da diventare liquido nella mano. Mendeleev fece lo stesso per lo scandio, germanio e tecnezio (che non fu scoperto fino al 1937, 30 anni dopo la sua morte).

Elenco degli elementi di John Dalton. Credito:Wikimedia Commons
A prima vista il tavolo di Mendeleev non assomiglia molto a quello che conosciamo. Per una cosa, il tavolo moderno ha un mucchio di elementi che Mendeleev ha trascurato (e non ha lasciato spazio), in particolare i gas nobili (come l'elio, neon, argon). E il tavolo è orientato in modo diverso dalla nostra versione moderna, con elementi che ora mettiamo insieme in colonne disposte in righe.
Ma una volta che hai dato una svolta di 90 gradi al tavolo di Mendeleev, la somiglianza con la versione moderna diventa evidente. Per esempio, gli alogeni – fluoro (F), cloro (Cl), bromo (Br), e Iodio (I) (il simbolo J nella tabella di Mendeleev) – appaiono tutti uno accanto all'altro. Oggi sono disposti nella 17a colonna della tabella (o gruppo 17 come preferiscono chiamarlo i chimici).

Tavolo di Dimitry Mendeleev completo di elementi mancanti. Credito:Wikimedia Commons
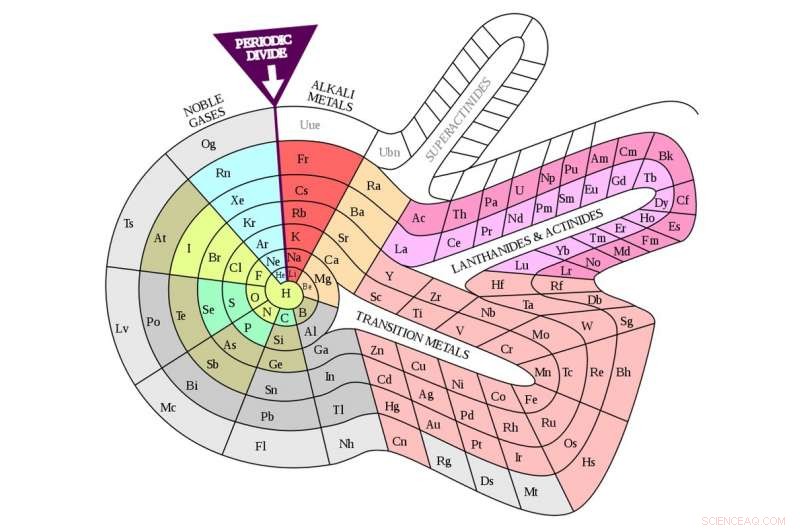
Periodo di sperimentazione
Può sembrare un piccolo salto da questo al diagramma familiare ma, anni dopo le pubblicazioni di Mendeleev, c'era molta sperimentazione con layout alternativi per gli elementi. Anche prima che il tavolo ottenesse il suo ribaltamento permanente ad angolo retto, la gente ha suggerito alcuni colpi di scena strani e meravigliosi.
Un esempio particolarmente eclatante è la spirale di Heinrich Baumhauer, pubblicato nel 1870, con idrogeno al centro ed elementi con massa atomica crescente che si sviluppano a spirale verso l'esterno. Gli elementi che cadono su ciascuno dei raggi della ruota condividono proprietà comuni proprio come quelli in una colonna (gruppo) lo fanno nella tabella di oggi. C'era anche la formulazione piuttosto strana del "manubrio" di Henry Basset del 1892.
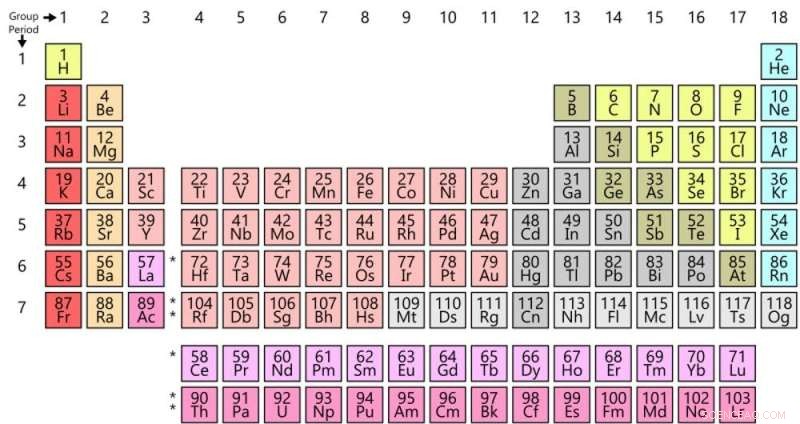
La tavola periodica di oggi. Credito:Offnfopt/Wikipedia
Tuttavia, all'inizio del XX secolo, il tavolo si era stabilizzato in un formato orizzontale familiare con la versione dall'aspetto sorprendentemente moderna di Heinrich Werner nel 1905. Per la prima volta, i gas nobili apparivano nella loro posizione ormai familiare all'estrema destra del tavolo. Werner ha anche cercato di prendere una foglia dal libro di Mendeleev lasciando dei vuoti, anche se ha piuttosto esagerato con il lavoro di ipotesi con suggerimenti per elementi più leggeri dell'idrogeno e un altro posto tra l'idrogeno e l'elio (nessuno dei quali esiste).
Nonostante questo tavolo dall'aspetto piuttosto moderno, c'era ancora un po' di riordino da fare. Particolarmente influente è stata la versione di Charles Janet. Ha adottato l'approccio di un fisico al tavolo e ha utilizzato una teoria quantistica appena scoperta per creare un layout basato su configurazioni di elettroni. La risultante tabella del "passo sinistro" è ancora preferita da molti fisici. interessante, Janet ha anche fornito spazio per elementi fino al numero 120 nonostante all'epoca ne fossero noti solo 92 (ora siamo solo al 118).

La spirale di Heinrich Baumhauer. Ristampato (adattato) con il permesso di Tipi di classificazioni grafiche degli elementi. III. Spirale, elicoidale, e grafici vari. Credito:G. N. Quam, Mary Battell Quam. Copyright (1934) American Chemical Society.
Stabilirsi su un design
Il tavolo moderno è in realtà una diretta evoluzione della versione di Janet. I metalli alcalini (il gruppo sormontato dal litio) e i metalli alcalino-terrosi (sormontati dal berillio) sono stati spostati dall'estrema destra all'estrema sinistra per creare una tavola periodica dall'aspetto molto ampio (forma lunga). Il problema con questo formato è che non si adatta bene a una pagina o a un poster, quindi in gran parte per motivi estetici gli elementi f-block vengono solitamente ritagliati e depositati sotto la tavola principale. Ecco come siamo arrivati al tavolo che oggi riconosciamo.
Questo non vuol dire che la gente non abbia armeggiato con i layout, spesso come tentativo di evidenziare correlazioni tra elementi che non sono immediatamente evidenti nella tabella convenzionale. Ci sono letteralmente centinaia di varianti (controlla il database di Mark Leach) con spirali e versioni 3D particolarmente popolari, per non parlare delle varianti più ironiche.
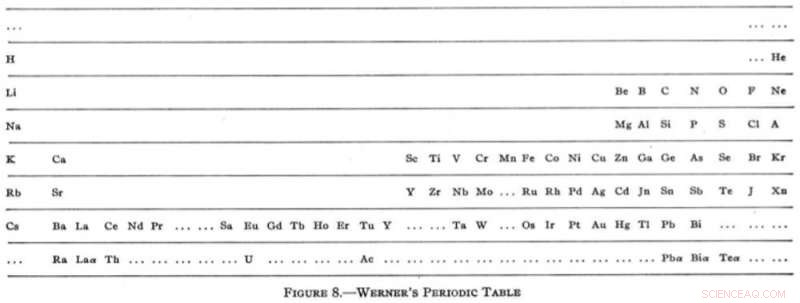
L'incarnazione moderna di Heinrich Werner. Ristampato (adattato) con il permesso di Tipi di classificazioni grafiche degli elementi. I. Introduzione e tavole brevi, G.N. Quam, Mary Battell Quam. Credito:American Chemical Society (1934)
Che ne dici della mia fusione di due grafiche iconiche, La tabella di Mendeleev e la mappa della metropolitana di Londra di Henry Beck qui sotto?
O la vertiginosa serie di imitazioni che mirano a dare un tocco scientifico alla categorizzazione di tutto, dalla birra ai personaggi Disney, e la mia "assurdità irrazionale" preferita in particolare. Tutto ciò dimostra come la tavola periodica degli elementi sia diventata il simbolo iconico della scienza.

Il tavolo del gradino sinistro di Charles Janet. Credito:Wikipedia, CC BY-SA

Versione 3D "Fiore di Mendeleev" del tavolo. Credito:Тимохова Ольга/Wikipedia, CC BY-SA
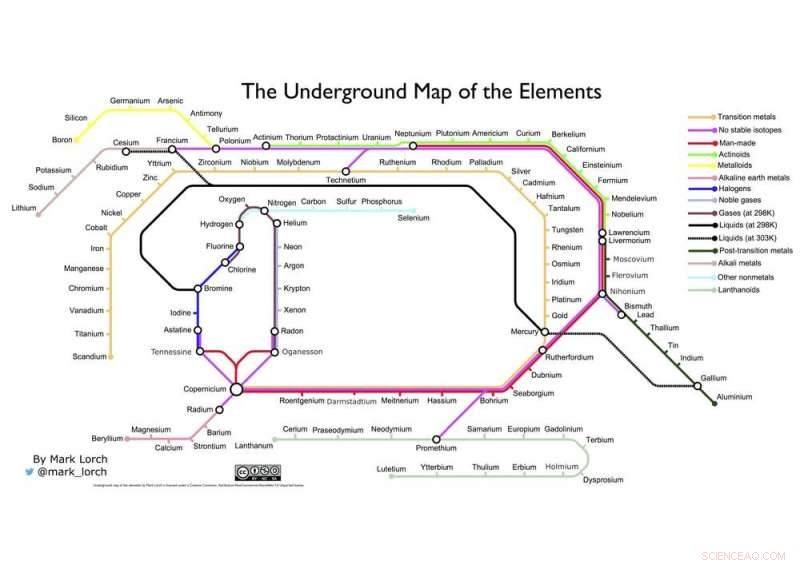
La mappa sotterranea degli elementi dell'autore. Credito:Mark Lorch, Autore fornito
Questo articolo è stato ripubblicato da The Conversation con una licenza Creative Commons. Leggi l'articolo originale. 