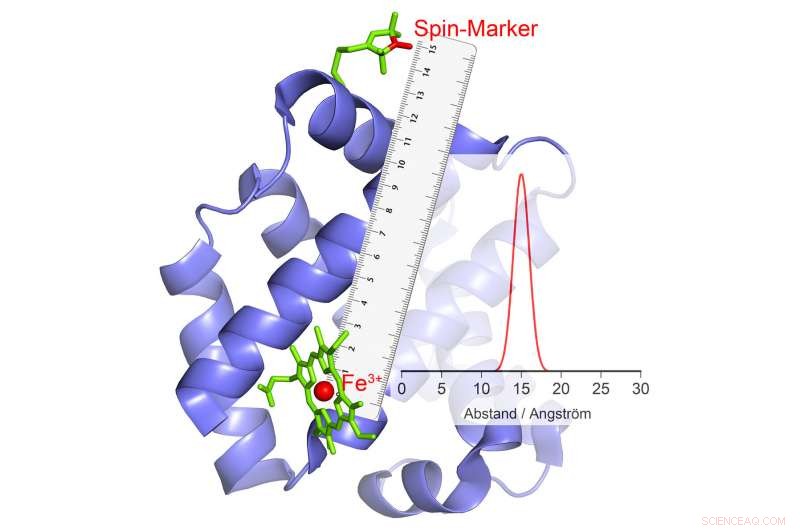
Se cambia la sua polarità, questo provoca un'eco nel marker magnetico, da cui calcolare la distanza. Credito:© AG Schiemann/Uni Bonn
Gli scienziati dell'Università di Bonn hanno sviluppato un metodo con il quale un enzima al lavoro può essere "fotografato". Il loro metodo consente di comprendere meglio la funzione di importanti biomolecole. I ricercatori sperano anche di ottenere informazioni sulle cause di alcuni disturbi enzimatici. Lo studio sarà pubblicato sulla rivista Chimica:una rivista europea .
Se un alieno vedesse per la prima volta l'immagine di un paio di forbici in un catalogo di forniture artigianali, probabilmente non avrebbe idea di cosa usiamo noi terrestri per questa cosa. Se, d'altra parte, gli doveva essere mostrato un video in cui le forbici si aprono e si chiudono, potrebbe forse dedurne la funzione con un po' di fantasia.
Gli scienziati hanno un approccio molto simile quando vogliono capire come funziona un enzima:se conoscono la struttura della molecola, quindi di solito solo come immagine fissa. Non sanno come si comporta l'enzima in azione, quali parti si muovono l'una verso l'altra e quali si allontanano l'una dall'altra.
Gli enzimi catalizzano alcune reazioni chimiche nelle cellule, paragonabile alle forbici che tagliano la carta. Hanno centri catalitici (le lame) che entrano in contatto con il materiale di partenza (la carta). "La forma tridimensionale dell'enzima di solito cambia durante questo processo, " spiega il Prof. Dr. Olav Schiemann dell'Istituto di Chimica Fisica e Teorica dell'Università di Bonn. "Normalmente, questi cambiamenti conformazionali non possono essere resi visibili, o solo con grande sforzo. Questo spesso rende difficile comprendere il meccanismo di catalisi".
Il gruppo di ricerca di Schiemann è riuscito a sviluppare un metodo con il quale è possibile misurare i movimenti di parti della proteina l'una contro l'altra nel corso della catalisi. Gli scienziati di Bonn stanno lavorando su tali metodi con grande successo ormai da diversi anni. Nel loro studio attuale, hanno esaminato un gruppo particolarmente importante di enzimi. Questi trasportano ioni metallici con numerosi elettroni spaiati nei loro centri catalitici. Un esempio è l'emoglobina, che lega l'ossigeno con l'aiuto di uno ione ferro e può quindi essere trasportato nel sangue.
Capovolgimento degli ioni
"I nostri metodi attuali non sono adatti a tali ioni ad alto spin, " spiega il collega di Schiemann, il dott. Dinar Abdullin. "Abbiamo quindi sviluppato un nuovo metodo, ha elaborato la teoria e l'ha testata con successo." I ricercatori hanno sfruttato il fatto che gli ioni ad alto spin si comportano come piccoli elettromagneti. Inoltre, possono cambiare casualmente la loro polarità:"capovolgono":il Polo Nord diventa il Polo Sud e il Polo Sud diventa il Polo Nord.
Questo fenomeno può essere utilizzato per la misurazione della distanza. Qui, gli scienziati collegano l'enzima con alcuni composti chimici che hanno anche proprietà elettromagnetiche. "Quando gli ioni ad alto spin si capovolgono, questi piccoli elettromagneti reagiscono al campo magnetico modificato nel loro ambiente cambiando anche la loro polarità, " spiega Abdullin. Quando e come lo fanno dipende, tra l'altro, dalla distanza dello ione ad alto spin. Ciò rende possibile determinare la distanza tra i due in modo così accurato.
Se più gruppi magnetici sono legati a un enzima, si ottiene la distanza di ciascuno di questi gruppi dallo ione ad alto spin e quindi dal centro catalitico. "Combinando questi valori, possiamo misurare la posizione spaziale di questo centro, come se stessimo usando un GPS molecolare, " spiega Schiemann. "Ad esempio, possiamo determinare come cambia la sua posizione rispetto agli altri gruppi magnetici nel corso della catalisi".
Però, gli scienziati non sono ancora in grado di osservare realmente l'enzima all'opera. "Stiamo ancora lavorando con cellule congelate, " dice Schiemann. "Questi contengono numerosi enzimi che sono stati congelati in diversi momenti durante la reazione catalitica. Quindi non otteniamo un film, ma una serie di "fermi immagine, come se le forbici dell'esempio introduttivo fossero state fotografate in innumerevoli momenti diversi durante il processo di montaggio.
"Ma stiamo già lavorando al prossimo miglioramento, sottolinea il chimico:“La misurazione spaziale delle biomolecole nelle cellule ea temperatura ambiente.” I ricercatori sperano di ottenere informazioni sullo sviluppo di alcune malattie che sono innescate da disturbi funzionali degli enzimi.