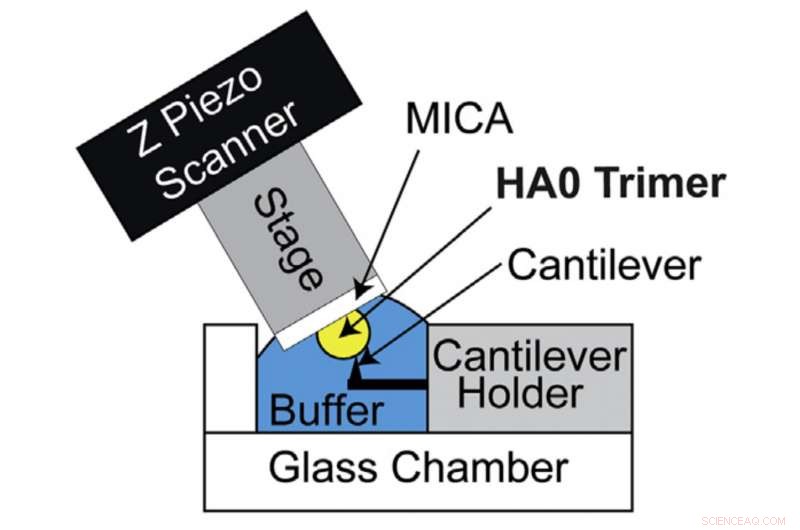
Configurazione HS-AFM per la visualizzazione diretta del trimero HA0. Schema schematico della configurazione HS-AFM per la scansione del trimero HA0. Credito:Università di Kanazawa
I virus dell'influenza A, responsabili di pandemie mortali in passato, rimangono ancora oggi un grave problema di salute pubblica globale. Le molecole note come fattori di virulenza sono prodotte da batteri, virus, e funghi per aiutarli a infettare le cellule ospiti. Uno dei fattori di virulenza trovati nei virus dell'influenza A è l'emoagglutinina (HA). I ricercatori dell'Università di Kanazawa hanno recentemente studiato la struttura dell'HA del virus dell'influenza aviaria, H5N1, utilizzando la microscopia a forza atomica ad alta velocità (HS-AFM). Le loro scoperte sono essenziali per lo sviluppo di approcci terapeutici contro i virus dell'influenza A in futuro.
L'HA è inizialmente sintetizzato dalle cellule ospiti nella sua forma precursore nota come HA0. La conversione di HA0 in HA dipende dalla patogenicità dei virus dell'influenza A:conversione extracellulare per virus dell'influenza A a bassa patogenicità e conversione intracellulare per virus dell'influenza A ad alta patogenicità. Perciò, comprendere la struttura e le proprietà di HA0 è fondamentale per decifrare HA. Richard Wong e il suo gruppo di ricerca hanno quindi cercato di esaminare HA0 al microscopio. La proteina ricombinante HA0 di H5N1 è stata analizzata visivamente dal sistema HS-AFM sviluppato dall'Università di Kanazawa.
Sia HA0 che HA esistono in forme omotrimeriche e la conversione di HA0 in HA non modifica significativamente la struttura omotrimerica. Perciò, è ragionevole utilizzare HA come modello per generare immagini di simulazione HA0 HS-AFM. Un ambiente endosomiale acido è il fattore critico per l'HA per indurre la fusione tra la membrana virale e la membrana endosomiale al fine di rilasciare materiali virali nelle cellule ospiti. Per chiarire l'effetto acido su HA0, è stato prima esposto ad un ambiente acido. Il trimero di HA0 si è rivelato molto sensibile alla soluzione acida e si è notevolmente espanso. Quando i cambiamenti conformazionali dell'emoagglutinina sono stati misurati in tempo reale utilizzando HS-AFM, il team ha scoperto che la sua area era più ampia, e la sua altezza più corta. L'ambiente acido rendeva essenzialmente la molecola più piatta e circolare, rispetto alla sua controparte originale. Questo cambiamento di conformazione è stato, però, reversibile in quanto la struttura è tornata alla sua forma originale dopo la neutralizzazione.
Questo studio ha aperto la strada allo studio degli eventi biologici all'interno dei virus in tempo reale. Gli autori affermano l'importanza di HS-AFM per questa ricerca:"Il nostro lavoro pilota stabilisce HS-AFM come uno strumento inimitabile per studiare direttamente le dinamiche delle proteine virali, che sono difficili da catturare con tecniche a basso segnale-rumore che si basano sulla media dell'ensemble, come cyro-EM e cristallografia a raggi X, ", afferma l'autore principale dello studio, il dott. Kee Siang Lim. "Con un'elevata velocità di scansione e un cantilever minimamente invasivo, prevediamo che HS-AFM sia fattibile per rivelare il flusso di cambiamenti conformazionali irreversibili di HA2 indotti da un pH basso, che imita i veri eventi biologici che si verificano quando l'HA entra in un endosoma ospite, in studi futuri."