Credito:Wiley
I batteri resistenti agli antibiotici rappresentano una crescente minaccia per la salute, rendendo essenziali nuovi antibiotici. I ricercatori tedeschi hanno recentemente fatto una svolta:hanno scoperto la lugdunina nel naso umano, un nuovo tipo di peptide ciclico che deriva dal batterio Staphylococcus lugdunensis e ha forti proprietà antimicrobiche contro lo Stahphylococcus aureus, tra gli altri. I ricercatori sono stati in grado di chiarire la modalità di azione sintetizzando varianti. Come spiegano nel diario Angewandte Chemie , è coinvolto il trasporto di protoni attraverso le membrane batteriche.
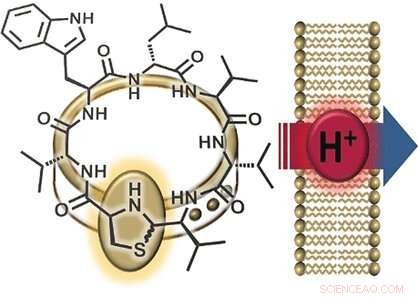
Una parte interessante della struttura della lugdunin è il suo gruppo tiazolidinico (un anello formato da un azoto, uno zolfo, e tre atomi di carbonio), che fa parte del suo anello peptidico. Questo anello a cinque membri ricorda un fermaglio che "adorna" l'anello peptidico. Per questa ragione, i ricercatori hanno chiamato la loro nuova classe di materiali "fibupeptidi, "dal latino perone , significato chiusura . Essendo riuscito in precedenza a sintetizzare il lugdunin, il team dell'Università di Tubinga e dell'Università di Göttingen (Germania) ha ottimizzato il percorso sintetico per produrre molti derivati diversi di questa sostanza naturale. Ciò ha permesso uno studio completo del meccanismo con cui funziona la lugdunin. I ricercatori hanno realizzato una serie di derivati in cui hanno sostituito ciascuno degli amminoacidi nell'anello peptidico con alanina, uno in cui hanno lasciato il "gancio dell'ornamento, " e un fibupeptide con una struttura che è l'immagine speculare della lugdunina. Hanno quindi usato questi derivati per eseguire test di attività.
Il gruppo, composto da chimici, biochimici, e microbiologi, scoperto che la struttura ciclica del peptide, la tiazolidina "fermaglio, " e due amminoacidi (triptofano e leucina), sono fondamentali per l'attività antibiotica del composto. Inoltre, l'anello peptidico deve essere sempre costituito da D- e L-amminoacidi alternati. Però, non c'era alcuna differenza nell'attività della molecola originale o nella sua immagine speculare. "Questo indica una mancanza di interazione recettore-ligando stereospecifica, " afferma Nadine Schilling, un membro del team guidato da Stephanie Grond, "Invece, parla per l'interazione con una piccola molecola o ione."
Un'ulteriore osservazione è stata che i derivati attivi della lugdunina abbattono il potenziale elettrico (la differenza di tensione tra l'interno e l'esterno) delle membrane cellulari batteriche, uccidendo così i batteri. L'incorporazione di un'ulteriore molecola di triptofano ha intensificato l'interazione con la membrana e ha rafforzato l'effetto antibatterico. Dice Grond:"Questi risultati suggeriscono il trasporto di ioni attraverso la membrana batterica". Per esaminare più da vicino questa caratteristica, i ricercatori hanno prodotto vescicole sintetiche con un gradiente di pH rispetto alla soluzione circostante. L'aggiunta di fibupeptidi attivi ha portato a una rapida equalizzazione del pH, senza distruzione della membrana o formazione di pori. "Il meccanismo consiste chiaramente nella traslocazione di protoni attraverso la membrana, " dice Grond. "Dobbiamo ancora determinare se il lugdunin agisce come un trasportatore mobile o un canale protonico".