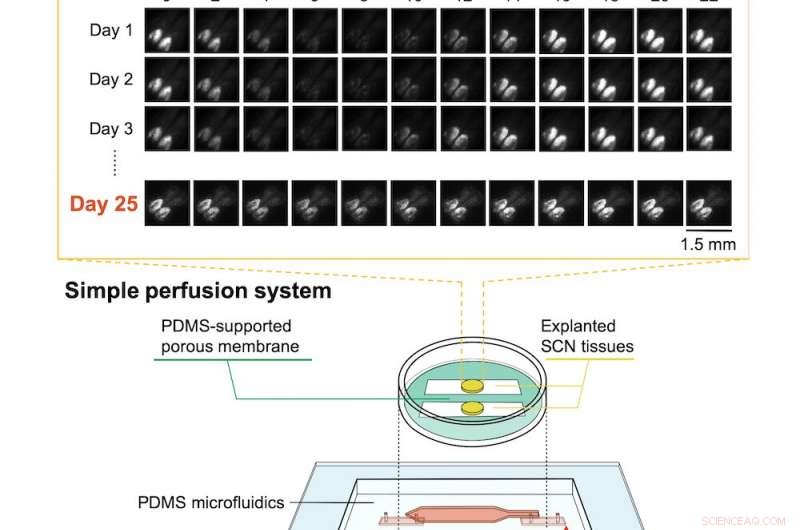
In basso:la configurazione del microdispositivo con tessuto del nucleo soprachiasmatico (SCN) espiantato. In alto:l'attività circadiana ritmica era ancora evidente dopo 25 giorni, come indicato dall'imaging a bioluminescenza. Attestazione:RIKEN
I ricercatori del RIKEN Center for Biosystems Dynamics Research in Giappone hanno sviluppato un nuovo sistema per mantenere i tessuti vitali per lo studio a lungo termine una volta trasferiti da un animale a un terreno di coltura. Il nuovo sistema utilizza un dispositivo microfluidico che può impedire ai tessuti di seccarsi e annegare nel fluido. Un esperimento di prova ha mostrato che il tessuto espiantato dal cervello del topo è rimasto vitale dopo quasi un mese di coltura, molto più a lungo di quanto sia possibile con altri metodi di coltura microfluidica, e anche molto più semplice.
La sperimentazione sui tessuti in coltura può facilitare la scoperta di farmaci perché i ricercatori possono manipolare sistematicamente il tessuto e testare diversi farmaci o combinazioni di farmaci. Però, quando si studia un intero sistema in cui molte cellule devono interagire tra loro, si è rivelato difficile mantenere il tessuto "vivo" per più di qualche giorno. Il tessuto si asciuga rapidamente e muore a meno che non venga messo in un terreno di coltura umido con nutrienti appropriati. D'altra parte, l'immersione di tessuti complessi in un fluido può danneggiare i tessuti perché non consente il normale trasferimento di gas tra di loro.
Risolvere questo problema, gli scienziati RIKEN hanno sviluppato un dispositivo microfluidico utilizzando polidimetilsilossano (PDMS), il materiale spesso usato come antischiuma nei farmaci da banco. Il dispositivo ha un canale semipermeabile circondato da una membrana artificiale e solide pareti PDMS. Invece di essere costantemente immersi nel fluido, il tessuto ha beneficiato della circolazione del mezzo di coltura all'interno del microcanale e del passaggio attraverso la membrana permeabile, che consentiva un corretto scambio di gas. Sembra semplice, ma trovare le impostazioni ottimali si è rivelato difficile. Come osserva il primo autore Nobutoshi Ota, "Controllare il flusso medio era difficile perché il microcanale che si è formato tra le pareti del PDMS e la membrana porosa era insolito. Tuttavia, abbiamo avuto successo dopo modifiche per tentativi ed errori alla membrana porosa e regolazioni delle portate di ingresso/uscita."
Il team ha testato il dispositivo utilizzando il tessuto del nucleo soprachiasmatico di topo, una parte complessa del cervello che governa i ritmi circadiani. I topi stessi erano topi knock-in in cui l'attività del ritmo circadiano nel cervello era collegata alla produzione di una proteina altamente fluorescente. Misurando il livello di bioluminescenza proveniente dal tessuto cerebrale, sono stati in grado di vedere che il tessuto tenuto in vita dal loro sistema è rimasto attivo e funzionale per oltre 25 giorni con una buona attività circadiana. In contrasto, l'attività neurale nei tessuti conservati in una coltura convenzionale è diminuita del 6% dopo solo 10 ore.
Questo nuovo metodo avrà diversi vantaggi. A breve termine, sarà utile per osservare lo sviluppo biologico e testare come i tessuti rispondono ai farmaci. Anche i vantaggi a lungo termine sono evidenti. "Questo metodo può essere utilizzato per più di tessuti espiantati da animali, ", afferma Ota. "Migliorerà anche la ricerca sull'organogenesi attraverso la coltura e l'osservazione a lungo termine, necessarie per la crescita di tessuti e organi".
Infatti, il team sta attualmente pianificando esperimenti a lungo termine utilizzando il loro sistema per osservare la formazione dei vasi sanguigni e i movimenti delle cellule durante la formazione degli organoidi.
Questo studio è stato pubblicato sulla rivista Scienze Analitiche .