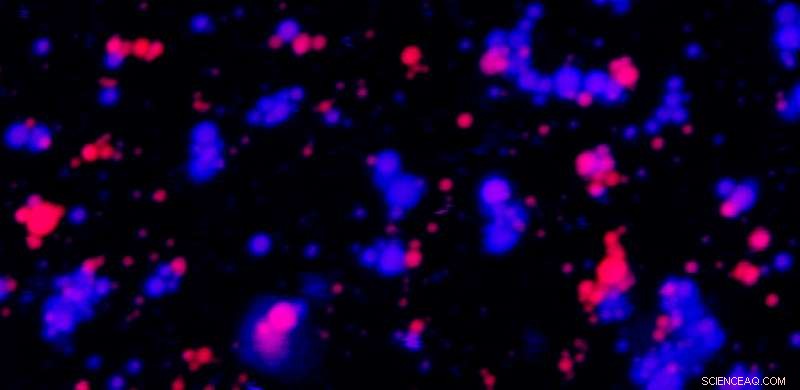
Un'immagine al microscopio a fluorescenza a due colori mostra goccioline liquide costituite da una proteina ricca di arginina e da un RNA ricco di purine. Le goccioline blu e rosse sono realizzate con gli stessi materiali (sia proteine che RNA), ma etichettati con coloranti diversi per aiutare la visualizzazione. In molti posti, le goccioline - fluttuanti liberamente in una soluzione - coesistono ma non si mescolano. Credito:Ibraheem Alshareedah / Laboratorio Priya Banerjee
Una nuova ricerca può aiutare a spiegare un fenomeno intrigante all'interno delle cellule umane:come gli organelli liquidi senza pareti sono in grado di coesistere come entità separate invece di fondersi insieme.
Queste strutture, chiamati organelli privi di membrana (MLO), sono goccioline liquide costituite da proteine e RNA, con ogni goccia che trattiene entrambi i materiali. Gli organelli svolgono un ruolo cruciale nell'organizzazione del contenuto interno delle cellule, e può fungere da centro di attività biochimica, reclutamento di molecole necessarie per svolgere le reazioni cellulari essenziali.
Ma come le diverse goccioline rimangano separate l'una dall'altra rimane un mistero. Perché non si combinano sempre per formare goccioline più grandi?
"Questi organelli non hanno alcuna membrana, e quindi, l'intuizione comune ti direbbe che sono liberi di mischiarsi, "dice Priya Banerjee, dottorato di ricerca, assistente professore di fisica presso l'Università del Buffalo College of Arts and Sciences.
Banerjee è il ricercatore capo del nuovo studio, che esplora perché questo non accade.
I coautori della ricerca includono il primo autore e il dottorato di ricerca in fisica. lo studente Ibraheem Alshareedah; dottorato in fisica lo studente Taranpreet Kaur; studente universitario Jason Ngo; studentessa di fisica e matematica Hannah Seppala; laureanda in ingegneria biomedica Liz-Audrey Djomnang Kounatse; e ricercatori post-dottorato in fisica Wei Wang e Mahdi Moosa. Tutti provengono da UB.
Le goccioline non si mescolano facilmente se assumono uno stato simile al gel
I risultati, pubblicati il 22 agosto su Giornale della Società Chimica Americana —indicare la struttura chimica delle proteine e delle molecole di RNA all'interno delle goccioline come un fattore chiave che può impedire agli MLO di mescolarsi.
Il team ha scoperto che alcuni tipi di RNA e proteine sono "più appiccicosi" di altri, consentendo loro di formare goccioline gelatinose che non si fondono facilmente con altre goccioline nello stesso stato viscoelastico. Nello specifico, le goccioline hanno maggiori probabilità di essere gelatinose quando contengono molecole di RNA ricche di un elemento costitutivo chiamato purina, e proteine ricche di un amminoacido chiamato arginina.

Taranpreet Kaur (a sinistra) e Ibraheem Alshareedah, dottorandi di fisica dell'Università di Buffalo, preparano una camera di flusso microfluidica per gli esperimenti. La microfluidica consente una rapida manipolazione delle goccioline proteiche sotto trappole ottiche, una tecnica utilizzata per condurre il nuovo studio. Credito:Douglas Levere / Università di Buffalo
Gli esperimenti non hanno avuto luogo nelle cellule. Anziché, i risultati si basavano su test eseguiti su sistemi modello costituiti da RNA e una proteina formante goccioline chiamata fusa nel sarcoma (FUS) che galleggia in una soluzione tampone.
Uno dei motivi per cui FUS è di interesse per i ricercatori è la sua potenziale connessione con la sclerosi laterale amiotrofica (SLA) malattia neurodegenerativa. Come spiega Banerjee, molecole proteiche ricche di arginina sono associate a una forma prevalente della malattia, nota come SLA mediata da c9orf72.
"La nostra scoperta indica un ruolo speciale delle proteine ricche di arginina nel determinare lo stato materiale - liquido vs gel - di organelli senza membrana, " Banerjee dice. "Questo studio può essere importante per capire come le proteine ricche di arginina legate alla SLA possono alterare lo stato viscoelastico degli MLO ricchi di RNA".
Oltre a fornire informazioni sul motivo per cui gli MLO resistono alla miscelazione (a causa della maggiore viscoelasticità), lo studio ha sondato il ruolo dell'RNA nella formazione e nella dissoluzione di organelli liquidi contenenti FUS. La ricerca ha scoperto che per il tipo di gocciolina studiata, l'aggiunta di basse concentrazioni di RNA a una soluzione contenente le proteine ha provocato la formazione di goccioline. Ma man mano che veniva aggiunto più RNA, le goccioline poi si sono dissolte.
"Di solito c'è una finestra molto piccola in cui esistono queste goccioline, ma la finestra è significativamente più ampia per le proteine ricche di arginina, " dice Banerjee.
La complicata vita degli organelli liquidi
Il nuovo documento è l'ultimo di una serie di studi che il gruppo di Banerjee ha condotto per esplorare le forze che governano la creazione, mantenimento e scioglimento di MLO.
Sebbene il team utilizzi sistemi modello per esaminare le proprietà individuali delle goccioline, è probabile che molte forze lavorino insieme in una cellula per determinare il comportamento e la funzione degli organelli, lui dice. Ci possono essere molti altri meccanismi, Per esempio, che fanno sì che gli MLO assumano uno stato gelatinoso o si rifiutino in altro modo di mescolarsi.
"Le cellule sono enormemente complesse, con molte molecole diverse che subiscono processi diversi che si uniscono allo stesso tempo per influenzare ciò che accade all'interno degli MLO, " Banerjee dice. "Utilizzando sistemi modello, siamo in grado di comprendere meglio come una particolare variabile possa influenzare la formazione e la dissoluzione di questi organelli. E ci aspettiamo di vedere queste stesse forze in gioco in natura, all'interno delle cellule".