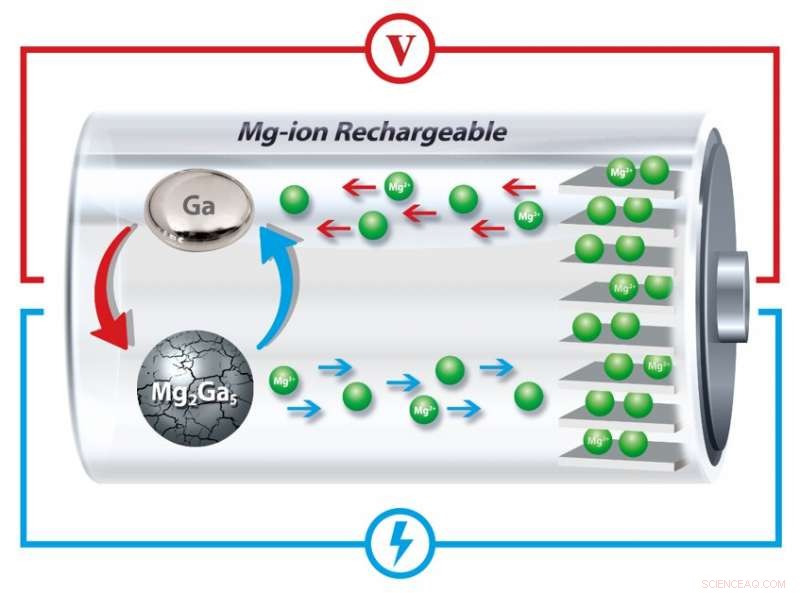
Nel nuovo design dell'anodo dei ricercatori, il gallio si scioglie e si solidifica ripetutamente, "guarire" le crepe che altrimenti diminuirebbero gradualmente la capacità della batteria di mantenere la carica. Credito:Università della Pennsylvania
Le batterie ricaricabili agli ioni di litio (Li-ion) sono una tecnologia rivoluzionaria, trovato in tutto, dai cellulari alle auto. La loro ubiquità e il loro ruolo nel rompere la dipendenza dai combustibili fossili ha fatto guadagnare a un trio di ricercatori il Premio Nobel per la Chimica di quest'anno.
Ma anche se la tecnologia delle batterie agli ioni di litio viene riconosciuta come uno dei premi più importanti della scienza, la chimica dietro di loro sta affrontando una sfida incombente. Le batterie agli ioni di litio non possono essere ricaricate a tempo indeterminato; i materiali negli elettrodi di queste batterie si espandono e si rompono ad ogni ciclo, diminuendo gradualmente le loro prestazioni di archiviazione fino a renderle inutili. La conseguente domanda di litio fresco, il cobalto e altri elementi necessari mettono a dura prova le risorse naturali.
Con questa sfida in mente, Penn Engineers sta cercando di progettare elettrodi per batterie ricaricabili che possano funzionare in modo efficiente con ioni metallici diversi dal litio. Le batterie agli ioni di magnesio sono un'alternativa promettente, ma i materiali che possono immagazzinare in modo reversibile il magnesio sono stati finora ancora più suscettibili al cracking e ad altri problemi rispetto ai loro cugini agli ioni di litio.
I ricercatori della Penn hanno ora trovato una soluzione incorporando gallio, un metallo che ha un punto di fusione di alcuni gradi superiore alla temperatura ambiente, nell'anodo di una batteria agli ioni di magnesio. Fondendo e solidificando ad ogni ciclo di carica e scarica, questi anodi possono "guarire" le screpolature e le successive dilatazioni che normalmente degradano lo stoccaggio delle batterie ricaricabili.
I loro esperimenti mostrano che questo nuovo anodo estende significativamente la vita delle batterie agli ioni di magnesio, e lo fa senza la necessità di costosi materiali su scala nanometrica. Queste caratteristiche potrebbero rendere le batterie agli ioni di magnesio una buona soluzione per applicazioni su larga scala, togliendo pressione alle risorse di litio.
I ricercatori hanno dimostrato il loro anodo a base di gallio in uno studio pubblicato su Materiali energetici avanzati .
Lo studio è stato condotto da Eric Detsi, Stephenson Term Assistant Professor presso il Dipartimento di Scienza e Ingegneria dei Materiali, insieme a Lin Wang e Samuel Welborn, studenti laureati nel suo laboratorio. Hanno collaborato con Vivek Shenoy, Eduardo D. Glandt Professore Emerito del Presidente del Dipartimento di Scienza e Ingegneria dei Materiali.
"Per la maggior parte dei veicoli elettrici, il peso della batteria rappresenta circa un quinto del peso complessivo del veicolo. Affidarsi esclusivamente alle batterie agli ioni di litio per alimentare questi veicoli in tutto il mondo metterà a dura prova le risorse di litio e cobalto utilizzate nelle batterie, " Dice Detsi. " Stanno già diventando più costosi a causa della domanda, e il mercato globale del cobalto dipende fortemente dalle forniture da paesi con alti rischi geopolitici".
"È ovvio che sono necessarie tecnologie alternative per le batterie, " dice. "Non per sostituire il litio, ma per supportare il litio."
Caricare e scaricare una batteria comporta reazioni chimiche che consentono agli ioni di spostarsi da un elettrodo della batteria all'altro, guadagnando o rilasciando elettroni nel processo. Però, chiunque abbia un cellulare o un laptop obsoleto sa che queste batterie perdono la capacità di mantenere la carica nel tempo. Uno dei motivi principali per cui queste batterie si guastano è che il ciclo di carica e scarica comporta una trasformazione fisica dei materiali negli elettrodi. Quando gli ioni sono incorporati nell'elettrodo, quei materiali si espandono, e quando gli ioni vengono rilasciati dall'elettrodo, i materiali si rompono. Questo processo continua fino a quando i materiali non si rompono e perdono fisicamente il contatto elettrico con gli elettrodi, rendendo la batteria inutilizzabile.
"Il cambiamento di volume che si verifica nella maggior parte dei materiali degli elettrodi a causa dell'incorporazione e del rilascio di ioni porta alla rottura e alla polverizzazione. È una delle cose che uccidono una batteria, " dice Wang. "Questa polverizzazione è associata all'accumulo di stress che deriva da una trasformazione di fase solido-solido".
"Nel nostro nuovo lavoro, però, "Welborn dice, "invece di una trasformazione da un tipo di solido in un altro, il materiale solido originario si trasforma in liquido. Ciò inibisce la fessurazione e la polverizzazione perché le sollecitazioni associate alla normale trasformazione solido-solido non sono più presenti".
A temperatura ambiente, il gallio puro è malleabile, metallo argenteo che potrebbe essere facilmente scambiato per alluminio o nichel. Tenendone un po' in mano, però, rivela rapidamente una proprietà unica:con un punto di fusione di 85 gradi Fahrenheit, la temperatura corporea è sufficiente per trasformare un pezzo solido di gallio in un liquido simile al mercurio.
Nel nuovo studio dei ricercatori, il gallio inizia in forma solida perché è legato al magnesio in particelle di dimensioni micron.
"Per collegare elettronicamente questi piccoli pezzi, "Wang dice, "li mettiamo in una rete conduttiva di fibre di carbonio, nerofumo e grafene che è tutto legato insieme con un legante."
Quando gli ioni magnesio si separano dal gallio, si trasforma allo stato liquido perché la batteria funziona a temperature leggermente superiori al punto di fusione del gallio.
"Dato che è impacchettato in questa rete di altri materiali, "Welborn dice, "quando il gallio passa da solido a liquido, non si muove come ci si potrebbe aspettare che faccia un liquido."
Utilizzando i raggi X per esaminare la struttura cristallina dei materiali all'interno della batteria, i ricercatori hanno dimostrato che quando la batteria si carica, gli ioni ritornano all'anodo e riformano particelle solide di gallio-magnesio.
criticamente, poiché queste particelle vengono ricostituite ad ogni ciclo, non sperimentano il tipo di rottura che alla fine degrada altre batterie.
La batteria sperimentale dei ricercatori ha resistito a più di mille cicli di ricarica, circa cinque volte di più rispetto all'attuale batteria agli ioni di magnesio allo stato dell'arte.
"I mille cicli dimostrati in questo lavoro rappresentano un miglioramento significativo, "Detti dice, "ma il nostro sogno è sfruttare questo comportamento di autoguarigione unico per progettare una batteria che possa essere caricata e scaricata per sempre".
Il limite alla durata di mille cicli della nuova batteria non è dovuto all'elettrodo, ma piuttosto l'elettrolita, il mezzo liquido che sposta gli ioni da un elettrodo all'altro. Ricerche precedenti del gruppo di Detsi hanno mostrato il ruolo svolto dall'elettrolita nel degradare lentamente gli elettrodi della batteria, e il lavoro futuro si concentrerà su come migliorare tale processo.
Fortunatamente, come con la progettazione degli elettrodi autorigeneranti dello studio, lavorare su questo aspetto della progettazione della batteria comporta applicazioni intelligenti della chimica, piuttosto che tecniche di nanotecnologia dai costi proibitivi comportano altri tentativi di prolungare la durata della batteria.
"Per risolvere i problemi con le batterie agli ioni di litio, la comunità delle batterie usa comunemente nanomateriali, " dice Detsi. "Tuttavia, la sintesi dei nanomateriali può essere complessa, il che significa che produrre tonnellate di nanomateriali su scala industriale per applicazioni a batteria può essere molto costoso. Una cosa notevole del nostro design è che non è necessario utilizzare nanomateriali, il che rende questa classe di batterie molto interessante per applicazioni su larga scala."