I ricercatori utilizzano potenti raggi X per rivelare strutture molecolari nel sito in cui i composti farmacologici interagiscono con i recettori cellulari. Queste strutture aiutano a indicare la strada per la progettazione dei farmaci del futuro. Credito:Greg Stewart/SLAC National Accelerator Laboratory
I ricercatori sperano di progettare una nuova generazione di farmaci contro una serie di malattie mortali. L'obiettivo, però, è costoso, arduo e spesso inefficace. Una delle sfide chiave è comprendere una particolare classe di proteine che adornano le superfici cellulari, che sono i bersagli della maggior parte dei farmaci.
Ora Wei Liu e i suoi colleghi del Biodesign Institute dell'ASU, insieme a un team guidato da Haitao Zhang e Vadim Cherezov dell'USC hanno esaminato un promettente bersaglio farmacologico con dettagli luminosi, utilizzando un dispositivo noto come laser a elettroni liberi a raggi X, o XFEL.
I loro risultati, che compaiono nell'edizione online avanzata della rivista Natura , gettare nuova luce su AT2R, un recettore cellulare critico, la cui gamma di funzioni i ricercatori hanno appena iniziato a scoprire. I risultati del gruppo potrebbero accelerare lo sviluppo di nuovi composti che affrontano le condizioni cardiovascolari, dolore neuropatico e crescita tissutale.
AT2R appartiene a una famiglia di recettori cellulari noti come GPCR (per il recettore accoppiato a proteine G), la più grande famiglia di recettori di membrana cellulare nel genoma umano. Come spiega Liu, I GPCR sono candidati così attraenti per essere presi di mira da nuovi farmaci perché forniscono linee essenziali di comunicazione tra l'ambiente esterno di una cellula e il suo funzionamento interno.
"Gli esseri umani hanno oltre 800 GPCR, " Liu dice "e ognuno di loro è importante, perché riconoscono migliaia di entità diverse dall'esterno della cellula, comprese le piccole molecole, peptidi, proteine e persino fotoni." La rodopsina GPCR fotosensibile, Per esempio, è fondamentale per la visione, i recettori olfattivi sono responsabili del senso dell'olfatto, mentre la caffeina nel caffè agisce legandosi ai recettori dell'adenosina, e così via.
Oltre ai loro ruoli vitali di pulizia, I GPCR forniscono bersagli farmacologici per il trattamento di una miriade di malattie umane. "Per quasi tutte le malattie con cui stiamo lottando, Le proteine GPCR potrebbero essere i potenziali bersagli farmacologici:recettori delle chemochine per l'HIV, recettori della serotonina per l'Alzheimer, recettori della dopamina per la tossicodipendenza e il Parkinson, " dice Liù.

La stazione sperimentale Coherent X-ray Imaging (CXI) presso il laser a raggi X Linac Coherent Light Source (LCLS) di SLAC è appositamente attrezzata per studiare le proteine cristallizzate in dettaglio su scala atomica. Questa stazione è stata utilizzata in uno studio sul recettore dell'angiotensina II AT2 legato a un composto farmacologico. Credito:SLAC National Accelerator Laboratory
Utilizzando potenti raggi X da Linac Coherent Light Source (LCLS) di SLAC e Advanced Photon Source (APS) dell'Argonne National Laboratory, gli scienziati hanno scoperto nuovi dettagli strutturali del recettore AT2R dell'angiotensina II che hanno sconcertato i ricercatori per due decenni. AT2R è uno dei due recettori dell'angiotensina II, e la sua coppia, AT1R, è stato utilizzato con successo come bersaglio per i farmaci per l'ipertensione.
Le informazioni rivelate dallo studio potrebbero offrire agli sviluppatori di farmaci un nuovo percorso per i composti che combattono il dolore e l'infiammazione o promuovono la rigenerazione dei tessuti agganciandosi comodamente in una tasca nell'elaborata forma tridimensionale di AT2R.
"A differenza del fratello AT1R, il recettore AT2 non è stato completamente compreso, " disse Cherezov, professore di chimica presso la University of Southern California e ricercatore principale dello studio. "Attraverso questo studio abbiamo scoperto molti dettagli importanti sulla struttura del recettore AT2 e su come si lega ai composti chimici, informazioni che stimoleranno ulteriori studi sulla funzione del recettore e potrebbero consentire un entusiasmante passo successivo nella scoperta di farmaci".
due recettori, molti misteri
Entrambi i recettori dell'angiotensina II, AT1 e AT2, sono componenti chiave di un sistema ormonale che aiuta a regolare la pressione sanguigna e i livelli di sodio nel sangue. Sono conosciute come "proteine di membrana" perché si trovano a cavallo delle membrane plasmatiche delle cellule, dove ricevono segnali da ormoni esterni alla cellula e li passano ai partner solubili all'interno della cellula, come proteine G o -arrestine, innescando una cascata di eventi che diffondono il segnale a tutta la cella.
Molti farmaci per l'ipertensione attualmente sul mercato prendono di mira il recettore AT1 a causa del suo ruolo ben noto nella regolazione della pressione sanguigna; bloccano AT1 per ridurre la pressione sanguigna. Il recettore AT2, d'altra parte, è ancora un bersaglio farmacologico sfuggente nonostante numerosi studi sulla sua funzione. Alcuni, ma non tutto, hanno dimostrato che contrasta gli effetti di AT1; altri indicano il suo potenziale per la protezione e la rigenerazione dei tessuti; e altri ancora suggeriscono che potrebbe svolgere un ruolo nel bloccare il dolore.
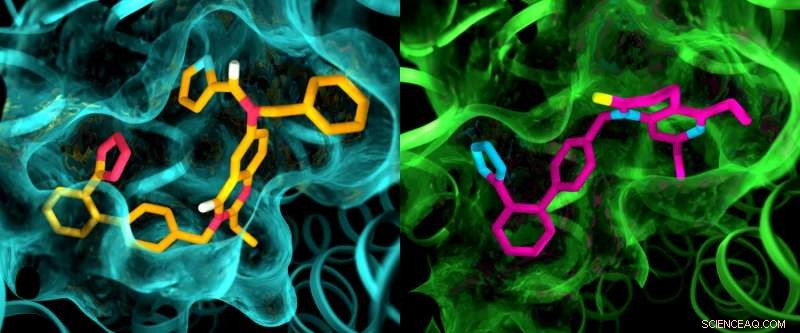
Sebbene si pensi che i due recettori dell'angiotensina II siano molto simili, uno studio a raggi X ha mostrato chiare differenze nelle tasche in cui i recettori si legano a composti simili a farmaci. Questa illustrazione mostra i dettagli nelle strutture delle tasche di AT2 (sinistra) e AT1 (destra). Credito:Greg Stewart/SLAC National Accelerator Laboratory
Sebbene non ci siano ancora farmaci approvati che agiscono sui recettori AT2, le aziende farmaceutiche stanno perseguendo in modo aggressivo composti che li attiveranno o li bloccheranno. Uno di questi composti, chiamato EMA401, è in fase di sperimentazione nei pazienti per il trattamento del dolore neuropatico.
L'ultimo studio si rivolge a due obiettivi:capire come AT2 differisce da AT1, al fine di indirizzarlo selettivamente; ed esplorando perché AT2 -che ha tutte le caratteristiche classiche di un GPCR, proprio come AT1 - non riesce ad attivare le proteine G, che diffondono segnali all'interno delle cellule, o interagire con arrestin, spegnendo quei segnali.
Biologia sotto la luce dei raggi X
Negli esperimenti, i ricercatori hanno esaminato due diversi tipi di campioni, che sono stati formati in cristalli per l'esame con i raggi X. In uno, il recettore AT2 era legato a un composto selettivo, uno che si lega solo ad AT2. Questi cristalli erano così piccoli che potevano essere studiati solo al laser a elettroni liberi a raggi X di SLAC LCLS, dove sono stati trasmessi attraverso un raggio di impulsi di raggi X ultraveloci.
Nell'altro, un composto non selettivo era legato sia ad AT1 che ad AT2. Questi campioni, che formava cristalli più grandi, sono stati sondati alla sorgente di luce di sincrotrone APS di Argonne.
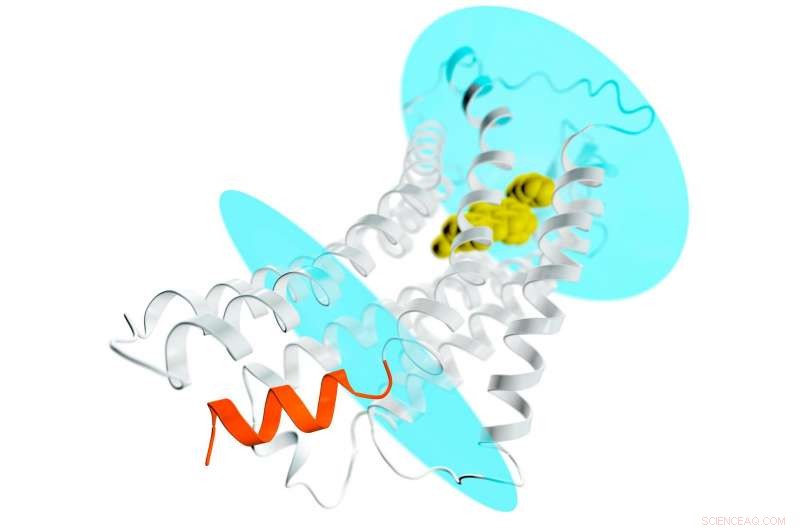
Una rappresentazione del recettore AT2 (spirali grigie e filamenti) che si estende attraverso una membrana cellulare; gli ovali blu rappresentano le superfici interna ed esterna della membrana. Un potenziale composto farmacologico è legato nella tasca esterna del recettore (gialla) stabilizzando il recettore in una conformazione simile a quella attiva. Ciò normalmente porterebbe all'attivazione delle proteine G e alla diffusione di un segnale in tutta la cellula. Ma nel caso di AT2, il punto in cui attraccano le proteine G per ricevere il segnale è bloccato da un'elica a forma di spirale (arancione) che fa parte del recettore. Questo nuovo dettaglio aiuta a spiegare perché i recettori AT2 non si legano e non attivano le proteine G, ma invece probabilmente trasmettono il segnale all'interno della cellula tramite altri meccanismi ancora sconosciuti. Credito:Greg Stewart/SLAC National Accelerator Laboratory
Risultati imprevisti
I risultati degli esperimenti sono stati sorprendenti in diversi modi. Primo, sebbene entrambi i composti siano stati progettati per bloccare e disattivare i recettori, hanno lasciato AT2 in uno stato che sembrava essere attivo. Inoltre, sebbene si pensasse che AT1 e AT2 fossero molto simili, le tasche dove i recettori si legano ai composti hanno mostrato marcate differenze.
"Questo è qualcosa che non abbiamo mai visto con i GPCR, " Ha detto Cherezov. "L'idea era sempre che i recettori che si legano agli stessi composti avrebbero tasche molto simili, quindi gli sforzi per sviluppare farmaci che agiscono su AT2 sono iniziati con le stesse strutture di base dei farmaci che agiscono su AT1. Ora vediamo che potremmo dover iniziare con molecole simili a farmaci completamente diverse che sono adattate per adattarsi al recettore AT2, che potrebbe impostare il processo di scoperta dei farmaci in una direzione diversa".
I partecipanti all'ASU hanno assistito con l'analisi dei dati, nonché con la preparazione e la caratterizzazione del campione. Liu, ex membro del team della USC, ha anche aiutato con la progettazione di costrutti recettoriali, purificazione e cristallizzazione.
Liu sottolinea che molte importanti proteine GPCR adatte a bersagli farmacologici sono solo in grado di formare cristalli molto piccoli (meno di 100 micron di lunghezza) in laboratorio. Storicamente, la capacità di far crescere grandi cristalli proteici in laboratorio era un prerequisito per studiare la loro struttura 3D ad alte risoluzioni, poiché i cristalli più piccoli verrebbero distrutti dalla radiazione di sincrotrone. Ora però, lo studio di queste molecole è stato rivoluzionato attraverso l'utilizzo della tecnologia XFEL, che espone i cristalli di dimensioni micron a così brevi raffiche di radiazioni che rimangono intatti.
L'ASU è all'avanguardia in questo nuovo campo di studi, combinando la loro esperienza nella produzione di piccoli cristalli adeguati per l'analisi delle proteine GPCR con la capacità di visualizzare tali campioni ad altissima risoluzione utilizzando XFEL.
Il Biodesign Institute ha recentemente intrapreso un audace progetto per costruire un XFEL compatto, primo nel suo genere, in grado di effettuare questo tipo di analisi strutturale delle proteine ad alta risoluzione, riducendo drasticamente i costi e migliorando l'accessibilità. (Attualmente, esistono solo 3 grandi macchine XFEL, lo stabilimento SLAC di Stanford, DESY ad Amburgo, Germania e SACLA XFEL, ad Harima, Giappone.)
"XFEL apre le porte a tutti questi bersagli proteici di membrana, "Liu dice, sottolineando che il campo della cristallografia a raggi X è ora pronto per un rapido avanzamento.