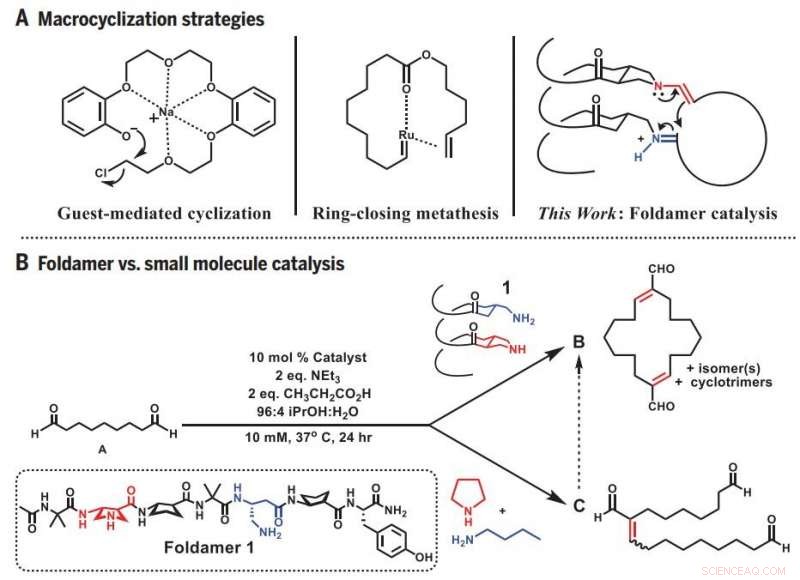
Strategie di macrociclizzazione. (A) Approcci precedenti e approccio foldamer alla macrociclizzazione. (B) Reattività divergente:Foldamer contro catalisi di piccole molecole. eq., equivalenti. Credito: Scienza (2019).DOI:10.1126/science.aax7344
Traendo ispirazione dalla natura, I chimici dell'Università del Wisconsin-Madison hanno scoperto un modo efficiente per litigare a lungo, molecole serpeggianti per formare grandi anelli, anelli che formano la spina dorsale di molti prodotti farmaceutici ma sono difficili da produrre in laboratorio.
Il lavoro potrebbe rappresentare un progresso preliminare verso la decifrazione di come gli enzimi, affinato dall'evoluzione, produrre composti naturali in modo così efficiente. Più immediatamente, il nuovo metodo potrebbe aiutare i ricercatori a sintetizzare farmaci che hanno una grande spina dorsale ad anello, come quelli per l'epatite. La ricerca è pubblicata il 19 dicembre sulla rivista Scienza .
La natura preferisce il disordine di un lungo, molecola flessibile dell'ordine di un anello rigido, il che rende notoriamente difficile per i chimici persuadere a formare grandi anelli in laboratorio. "Se le molecole lineari si allungano abbastanza, è come se le estremità non sapessero più di essere collegate, e hanno la stessa probabilità di legarsi con altre molecole quanto di unirsi, ", afferma il professore di chimica della UW-Madison Sam Gellman, l'autore anziano della relazione.
Eppure gli enzimi biologici possono facilmente unire queste estremità e formare anelli di tutte le dimensioni. Compiono questa impresa grazie al loro complesso, forme tridimensionali che agiscono come un lucchetto specializzato:la molecola lineare si inserisce in posizione come una chiave nel modo giusto affinché abbia luogo una reazione organizzata.
Sia per studiare come funzionano gli enzimi che per imitare le loro capacità, La squadra di Gellman è diventata molto più piccola, molecole tridimensionali simili a proteine chiamate foldameri che il loro laboratorio ha aiutato a sviluppare.
Poiché il foldamer ha una forma tridimensionale che può aggrapparsi alle estremità della molecola precursore flessibile, aumenta notevolmente le probabilità che le estremità si incontrino. Allo stesso tempo, il foldamer catalizza la giusta reazione che lega le estremità in un anello chiuso. Il risultato è la sintesi diretta e prevedibile di un impegnativo, e utile, forma molecolare.
"Come chimici, vediamo come gli enzimi siano straordinariamente efficaci nel fare reazioni che sono difficili da realizzare in un pallone, ma non capiamo veramente come funzionano, " dice Gellman. "Se impariamo come funzionano questi piccoli catalizzatori pieghevoli, potremmo essere in grado di costruire catalizzatori efficaci per molte reazioni diverse. In definitiva, forse possiamo avviare la nostra strada verso foldameri che hanno un'attività veramente simile a un enzima."
Lo studente laureato e autore principale Zebediah Girvin ha iniziato la ricerca testando le capacità di un breve, piegatrice a spirale. Girvin ha cercato di usare il foldamer per piegare una molecola lineare contenente nove atomi di carbonio in modo da formare un anello. Ma invece di un anello delle dimensioni previste, Girvin ne ha ottenuto uno due volte più grande, il risultato di due molecole precursori che prima si uniscono e poi chiudono il cerchio.
"Questa è una situazione comune nella scienza. Provi qualcosa e non funziona come ti aspettavi, " dice Gellman. "La sfida è riconoscere quando il risultato sorprendente è interessante quanto l'obiettivo originale, o anche più interessante."
Guidato da questa serendipità, Girvin iniziò a testare quanto bene il foldamer potesse produrre gli anelli più grandi che sembrava preferire creare. Ha scoperto che poteva facilmente fabbricare anelli composti da 12 a 22 atomi di carbonio quando i siti reattivi del foldamer, dove avviene la chiusura dell'anello, erano allineati l'uno con l'altro su un lato. Questo orientamento ha portato le due estremità di diverse molecole lineari abbastanza vicine da fondersi.
Come prova di concetto per la nuova tecnica, Girvin ha sintetizzato da zero il prodotto naturale robustol. Derivato dalle foglie della quercia setosa australiana, il robustol pesa con un potente anello da 22 atomi.
Il team di Gellman è molto entusiasta del potenziale dei foldamer per catalizzare altre reazioni utili e possibilmente aiutare a svelare misteri di vecchia data su come gli enzimi, i virtuosi chimici della natura, produrre le molecole necessarie per la vita semplicemente disponendo gli amminoacidi nella giusta forma. Mentre quelle risposte sono lontane anni, la tecnica di chiusura dell'anello che hanno scoperto potrebbe avere un uso più immediato sintetizzando i candidati farmaci. Il farmaco per l'epatite C vaniprevir, che viene utilizzato in Giappone e negli studi in fase avanzata negli Stati Uniti, contiene proprio questo tipo di anello grande.
Il vero potenziale dei foldamer deriva dalla loro diversità. I chimici possono produrre una varietà quasi infinita di pieghevoli in laboratorio perché hanno accesso a più elementi costitutivi di quelli che si trovano nelle proteine naturali. Ciò potrebbe consentire ai chimici di costruire catalizzatori più utili, che ha portato Gellman a brevettare alcuni foldamers e ha fondato la società Longevity Biotech per esplorare i loro usi terapeutici.
Andando avanti, quella ricchezza di opzioni consentirà ai ricercatori di organizzare questi catalizzatori in forme che potrebbero essere utili in modi inaspettati. Solo più ricerche lo diranno.
"Non sappiamo ancora di cosa siano capaci questi catalizzatori, " dice Girvin. "Ci vorranno anni per capire il loro potenziale, ed è importante gettare una rete ampia e mantenere le menti aperte su ciò che possiamo realizzare con questi nuovi strumenti".