Credito:Wiley
Lo stato di ripiegamento delle proteine nelle cellule vive riflette spesso la salute generale della cellula. Gli scienziati australiani hanno sviluppato una sonda molecolare che rileva lo stato del proteoma, l'intero insieme delle proteine, misurando la polarità dell'ambiente proteico. Il segnale di fluorescenza della sonda quantifica lo spiegamento e il suo cambiamento di colore camaleontico mappa le regioni cellulari di misfolding potenziato, dice lo studio pubblicato sulla rivista Angewandte Chemie .
Se le cellule vive sono stressate, i meccanismi di sintesi proteica e di correzione del ripiegamento sono sbilanciati. Le proteine mal ripiegate rimangono bloccate, si verifica una maggiore degradazione, e proteine inattive e detriti proteici si aggregano per formare granuli e condensati nel citoplasma. Tali aggregati svolgono un ruolo importante nelle malattie neurodegenerative e nel cancro. Un fattore trainante per l'aggregazione di proteine mal ripiegate sembra essere la polarità, la distribuzione elettronica in un ambiente. Yuning Hong e colleghi della La Trobe University Melbourne e dell'Università di Melbourne, Australia, hanno progettato una sonda fluorogenica bimodale per monitorare l'aggregazione proteica in modo più dettagliato.
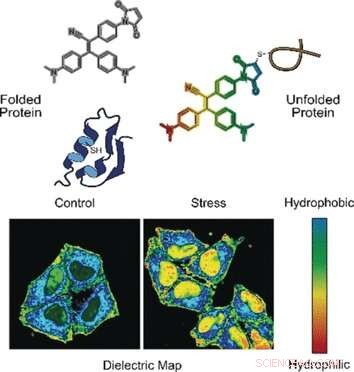
In una modalità, la sonda rileva proteine mal ripiegate. Le proteine correttamente ripiegate sono spesso stabilizzate da ponti costituiti dall'aminoacido cisteina. Questi ponti sono di solito profondamente sepolti, mentre le proteine mal ripiegate espongono i residui di cisteina in superficie. Quando la sonda si lega alla cisteina esposta da una catena proteica mal ripiegata, la fluorescenza è accesa, spiegare gli autori.
Nell'altra modalità, la sonda valuta la polarità. Gli ambienti polari indicano una distribuzione elettronica sbilanciata, che può essere misurato dalla costante dielettrica. Per misurare questo parametro, i ricercatori hanno aggiunto un gruppo chimico elettronico "push-pull" alla sonda fluorogenica. Hanno osservato che, in soluzioni polari ad alta costante dielettrica, la sonda fluorogenica denominata NTPAN-MI emetteva il suo segnale di fluorescenza con uno spostamento di colore. Questo cambiamento di colore "camaleontico" indica quindi un cambiamento di polarità.
Gli autori hanno testato la sonda NTPAN-MI su una linea cellulare umana, che hanno sottolineato aggiungendo farmaci che interferivano con la sintesi proteica e il ripiegamento. Gli scienziati hanno osservato una normale fluorescenza nelle cellule non trattate, ma brillante fluorescenza quando le proteine spiegate o mal ripiegate si accumulano in cellule trattate con tossine o infettate da virus. Inoltre, il cambiamento di colore segnalava la polarità dell'ambiente e quindi lo stato del proteoma di ciascun compartimento cellulare. I ricercatori hanno riferito di aver visualizzato per la prima volta il "carico proteico non ripiegato" nel nucleo. I metodi precedenti potevano misurare solo le proteine non ripiegate nel citoplasma.
Con le sue due modalità di rilevamento, la misurazione del dispiegamento e la polarità dell'ambiente proteico, la sonda NTPAN-MI fornisce un quadro più nitido delle risposte allo stress delle cellule vive rispetto a quello che può essere ottenuto con solo sonde unimodali o metodi diversi. Gli autori sottolineano che il loro metodo consentirebbe agli scienziati di ottenere una conoscenza più accurata della diafonia dei componenti cellulari in risposta allo stress.