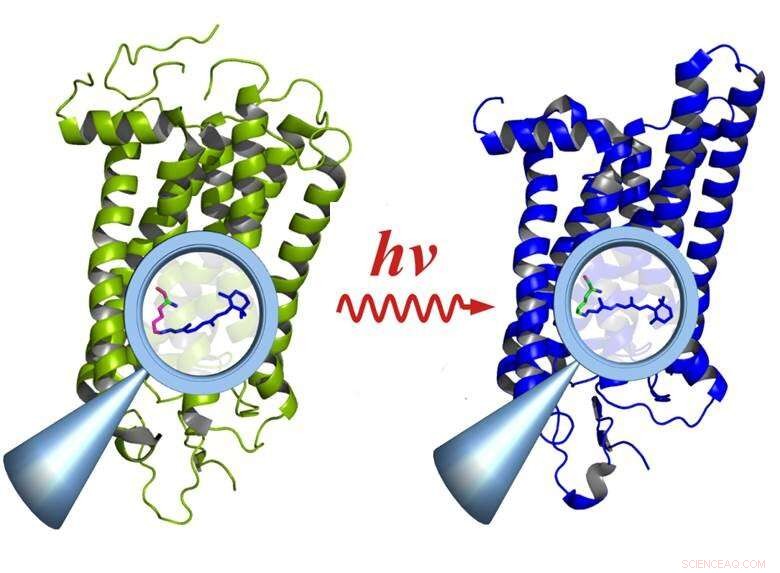
Rodopsina prima (a sinistra) e dopo l'attivazione mediante luce (a destra):l'attivazione provoca cambiamenti nei gruppi funzionali all'interno della molecola (lente d'ingrandimento), che interessano l'intera molecola. Credito:E. Ritter/HZB
La spettroscopia infrarossa risolta nel tempo nell'intervallo inferiore al millisecondo è un metodo importante per studiare la relazione tra funzione e struttura nelle molecole biologiche. Però, il metodo funziona solo se la reazione può essere ripetuta molte migliaia di volte. Questo non è il caso di un gran numero di processi biologici, anche se, perché spesso si basano su reazioni molto rapide e irreversibili, per esempio nella visione. I singoli quanti di luce che entrano nei bastoncelli della retina attivano le molecole proteiche della rodopsina, che poi decadono dopo aver svolto la loro funzione di fototrasduzione.
Ora un team guidato dal Dr. Ulrich Schade (HZB) e dal Dr. Eglof Ritter (Humboldt-Universität zu Berlin) presso la linea di luce IRIS di BESSY II ha sviluppato un nuovo strumento in grado di rilevare questo tipo di reazioni molto veloci e/o irreversibili con una singola misurazione. La risoluzione temporale è di pochi microsecondi. Lo strumento, uno spettrometro Féry, utilizza un rivelatore altamente sensibile noto come array di rivelatori sul piano focale e un'ottica speciale per sfruttare in modo ottimale la brillante radiazione infrarossa della sorgente di sincrotrone BESSY II. Il team ha utilizzato questo dispositivo per osservare per la prima volta l'attivazione della rodopsina in condizioni quasi in vivo.
"Abbiamo usato la rodopsina perché decade irreversibilmente dopo essere stata eccitata dalla luce ed è quindi un vero banco di prova per il sistema, " spiega Ritter, primo autore dello studio. La rodopsina è una molecola proteica che funge da recettore ed è il pigmento visivo che si trova nei bastoncelli della retina dell'occhio. Anche i singoli fotoni possono attivare la rodopsina, consentendo all'occhio di percepire livelli di luce estremamente bassi. Inoltre, la rodopsina è l'elemento comune in una classe di recettori con centinaia di membri responsabili dell'olfatto, gusto, sensazione di pressione, ricezione ormonale, ecc., che funzionano tutti in modo simile.
Il team ha anche studiato per la prima volta un'altra eccitante proteina nella gamma degli infrarossi:l'actinorodopsina. Questa molecola è in grado di convertire l'energia luminosa in corrente elettrica, una proprietà che alcuni batteri usano per generare energia elettrochimica per il loro metabolismo.
"Il nuovo metodo ci consente di studiare i meccanismi di reazione molecolare di tutti i processi irreversibili (o processi ciclici lenti), come quelli nel campo della conversione e dello stoccaggio dell'energia, Per esempio, " ha sottolineato Schade, che guida il team IRIS.