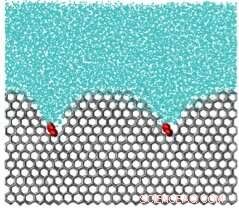
Una simulazione di una molecola che inibisce il ghiaccio. La molecola, in rosso, è come un peso sulla superficie del cristallo di ghiaccio, curvandolo e impedendo un'ulteriore crescita dei cristalli di ghiaccio. Credito:Università dello Utah
Le terapie cellulari sono molto promettenti per rivoluzionare il trattamento dei tumori e delle malattie autoimmuni. Ma questa industria multimiliardaria richiede la conservazione a lungo termine delle cellule in condizioni criogeniche super fredde, assicurandosi che continueranno a funzionare dopo lo scongelamento. Però, queste temperature fredde innescano la formazione e la crescita del ghiaccio, che può perforare e lacerare le cellule. Ricerca pubblicata su Giornale della Società Chimica Americana dei chimici Pavithra Naullage e Valeria Molinero dell'Università dello Utah fornisce le basi per progettare polimeri efficienti in grado di prevenire la crescita del ghiaccio che danneggia le cellule.
L'antigelo della natura
Le attuali strategie per crioconservare cellule e organi prevedono di bagnarli con grandi quantità di dimetilsolfossido, una sostanza chimica tossica che rovina la formazione di ghiaccio ma stressa le cellule, diminuendo le loro probabilità di sopravvivenza.
Natura, però, ha trovato un modo per mantenere in vita gli organismi in condizioni di freddo estremo:le proteine antigelo. Pesce, insetti e altri organismi a sangue freddo hanno sviluppato potenti glicoproteine antigelo che si legano ai cristalli di ghiaccio e impediscono loro di crescere e danneggiare le cellule.
L'area in crescita delle terapie cellulari richiede lo sviluppo di potenti inibitori della ricristallizzazione del ghiaccio che possono competere nell'attività con le glicoproteine naturali antigelo ma non hanno il costo e la tossicità del dimetilsolfossido. Questa richiesta ha stimolato la sintesi di polimeri che imitano l'azione delle glicoproteine antigelo. Ma il più potente inibitore della ricristallizzazione del ghiaccio sintetico trovato fino ad oggi, alcol polivinilico (PVA), è ordini di grandezza meno potente delle glicoproteine naturali.
"Gli sforzi per identificare inibitori più potenti per la crescita del ghiaccio sembrano essersi fermati, poiché non esiste ancora una comprensione molecolare dei fattori che limitano l'efficienza di inibizione della ricristallizzazione del ghiaccio dei polimeri, "dice Molinero.
Una variabile di progettazione polimerica nascosta
In che modo le molecole impediscono ai cristalli di ghiaccio di ingrandirsi? Le molecole che si legano fortemente al ghiaccio fissano la sua superficie, come le pietre su un cuscino, facendo sì che il fronte del ghiaccio sviluppi una superficie curva attorno alle molecole. Questa curvatura destabilizza il cristallo di ghiaccio, arrestandone la crescita. Le molecole che rimangono legate al ghiaccio per tempi più lunghi del tempo necessario per far crescere i cristalli di ghiaccio riescono a prevenire un'ulteriore crescita e ricristallizzazione.
Molinero e Naullage hanno utilizzato simulazioni molecolari su larga scala per chiarire le basi molecolari di come flessibilità, la lunghezza e la funzionalizzazione dei polimeri controllano il loro legame al ghiaccio e la loro efficienza nel prevenire la crescita del ghiaccio. Il loro studio mostra che il tempo di legame delle molecole sulla superficie del ghiaccio è controllato dalla forza del loro legame con il ghiaccio accoppiato con la lunghezza del polimero e dalla velocità con cui si propagano sulla superficie del ghiaccio.
"Abbiamo scoperto che l'efficienza dei polimeri flessibili nell'arrestare la crescita del ghiaccio è limitata dalla lenta propagazione del loro legame al ghiaccio, "dice Molinero.
Lo studio analizza i vari fattori che controllano il legame dei polimeri flessibili al ghiaccio e che spiegano il divario nella potenza del PVA e delle glicoproteine antigelo naturali. In poche parole, ogni blocco di glicoproteine antigelo si lega più fortemente al ghiaccio rispetto al PVA, e sono anche favoriti dalla loro struttura molecolare secondaria che separa i blocchi leganti e non leganti per consentire loro di attaccarsi più velocemente al ghiaccio per fermarne la crescita.
"Per quello che ci risulta, questo lavoro è il primo a identificare il tempo di propagazione del legame come una variabile chiave nella progettazione di polimeri flessibili efficienti che legano il ghiaccio, " Naullage dice. "Il nostro studio pone le basi per la progettazione de novo di polimeri flessibili che possono soddisfare o addirittura superare l'efficienza delle glicoproteine antigelo e avere un impatto nella ricerca biomedica".