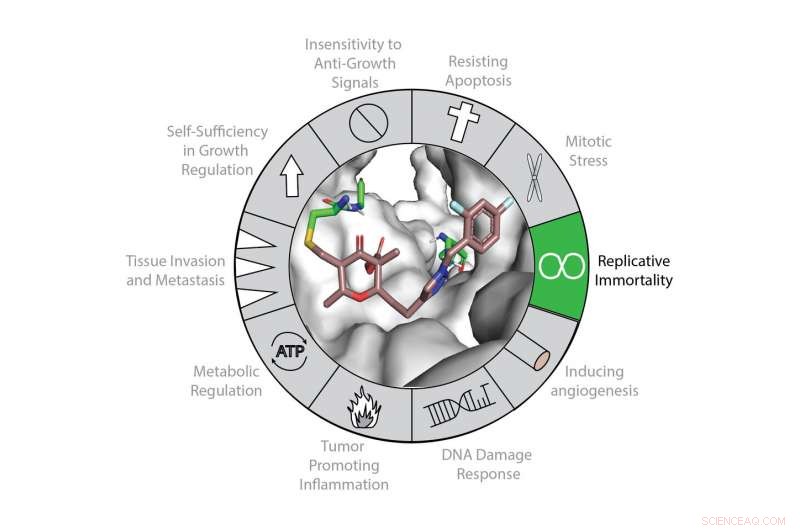
L'espressione della telomerasi contribuisce ai "segni distintivi del cancro" principalmente attraverso il suo ruolo canonico nel mantenimento dei telomeri e nella mortalità replicativa. La telomerasi (mostrata in grigio) può essere inibita con una nuova classe di inattivatori covalenti (mostrata a colori). Credito:Northwestern University
Uno dei segni distintivi del cancro è l'immortalità cellulare. Un chimico organico della Northwestern University e il suo team hanno ora sviluppato un promettente strumento molecolare che prende di mira e inibisce uno degli ingranaggi alla base dell'immortalità cellulare:l'enzima telomerasi.
Questo enzima si trova sovraespresso in circa il 90% delle cellule tumorali umane ed è diventato un importante oggetto di studio per i ricercatori sul cancro. Le cellule normali hanno il gene per la telomerasi, ma in genere non è espresso.
"La telomerasi è l'enzima primario che permette alle cellule cancerose di vivere per sempre, " ha detto Karl A. Scheidt, che ha condotto la ricerca. "Vogliamo cortocircuitare questa immortalità. Ora abbiamo progettato una piccola molecola unica nel suo genere che si lega irreversibilmente alla telomerasi, interrompendone l'attività. Questo meccanismo offre un nuovo percorso per il trattamento del cancro e la comprensione dell'invecchiamento cellulare".
Scheidt è professore di chimica al Weinberg College of Arts and Sciences e professore di farmacologia alla Northwestern University Feinberg School of Medicine.
La grande idea per il design della piccola molecola è venuta dalla natura. Un decennio fa, Scheidt era incuriosito dall'attività biologica della crolattomicina, che è prodotto da batteri e ha dimostrato di inibire la telomerasi.
Scheidt e il suo team hanno usato la crolattomicina come punto di partenza nella progettazione delle loro piccole molecole. Hanno prodotto più di 200 composti nel corso degli anni, e il composto che chiamano NU-1 è stato il più efficace di quelli testati. La sua sintesi è molto efficiente, facendo meno di cinque passi.
"NU-1 inibisce la telomerasi a differenza di qualsiasi cosa sia venuta prima, " Scheidt ha detto. "Lo fa formando un legame covalente. Un altro vantaggio di NU-1 è che la sua struttura molecolare dovrebbe consentire agli scienziati di aggiungere carichi, come un terapeutico."
Lo studio è stato pubblicato la scorsa settimana dalla rivista ACS Biologia Chimica .
Tutte le cellule umane hanno telomeri, brevi sequenze di DNA che ricoprono le estremità di ciascun filamento di DNA. Il loro compito è proteggere i nostri cromosomi e il DNA. Quando una cellula si divide, i telomeri si accorciano fino a quando non possono più svolgere il loro lavoro. Segue la morte cellulare naturale.
In contrasto, cellule cancerogene, con la loro accresciuta attività telomerasica, diventare immortali invertendo il normale processo di accorciamento dei telomeri. L'enzima telomerasi copia i telomeri più e più volte, allungamento dei telomeri. Il risultato è la divisione cellulare e l'immortalità illimitate. Le famose cellule HeLa, isolato dal tessuto del cancro cervicale di Henrietta Lacks negli anni '50, stanno ancora dividendo.
La telomerasi è da decenni un obiettivo della ricerca sulle terapie antitumorali. Nel 2009, tre scienziati hanno ricevuto il Premio Nobel per la Fisiologia o la Medicina per le loro precedenti ricerche sui telomeri e la telomerasi.
Dopo aver sviluppato i loro nuovi composti, Scheidt e il suo team hanno avviato collaborazioni con il professor Stephen Kron dell'Università di Chicago e Scott Cohen del Children's Medical Research Institute di Sydney per studiare il ruolo extra-telomerico dell'inibizione della telomerasi.
Gli studi si sono concentrati su come i nuovi composti interagiscono con la telomerasi a livello molecolare e su come l'inibizione della telomerasi sensibilizzi le cellule alle chemioterapie e all'irradiazione. Da questo lavoro, NU-1 è salito in cima.
"Con la pubblicazione di questo studio, stiamo testando questo squisito strumento per vedere cosa può fare e per saperne di più sulla telomerasi, " Scheidt ha detto. "Stiamo anche continuando a migliorarlo".
La ricerca è stata condotta su cellule umane. I prossimi passi, Scheidt ha detto, sono per produrre composti più potenti e studiarli in modelli animali.