
Immagini di cristalli di F420H2-ossidasi ottenuti in aerobiosi con una dimensione tipica di 0,1 mm. Con l'ossigeno il Fe e la flavina all'interno dell'enzima danno il colore giallo naturale ai cristalli. Credito:Max Planck Institute for Marine Microbiology/T. Wagner
Il metano è un potente gas serra che svolge un ruolo centrale nel ciclo globale del carbonio. Allo stesso tempo, è un'importante fonte di energia per noi umani. Circa la metà della sua produzione annuale è costituita da microrganismi noti come metanogeni che decompongono il materiale organico come le piante morte. Ciò avviene normalmente in un habitat senza ossigeno poiché questo gas è letale per i metanogeni. Ma anche in habitat effettivamente privi di ossigeno, occasionalmente compaiono molecole di ossigeno. Per rendere innocui questi intrusi, i metanogeni possiedono uno speciale enzima in grado di convertire l'ossigeno in acqua.
"Gli enzimi sono componenti vitali del metabolismo di tutti gli organismi viventi e l'obiettivo del nostro laboratorio è capire come funzionano queste nanomacchine a livello molecolare, " dice Tristan Wagner del Max Planck Institute for Marine Microbiology e primo autore dello studio, pubblicato sulla rivista scientifica Comunicazione chimica nel settembre 2020. Per lo studio, Wagner coltivava un microrganismo anaerobico chiamato Methanothermococcus thermolithotrophicus, che ha avuto origine dai sedimenti del Golfo di Napoli. Ha purificato l'enzima F420-ossidasi, una proteina flavonoide, e lo cristallizzò, un metodo comune per studiare il funzionamento degli enzimi.
"Si sapeva già che la F420-ossidasi può convertire l'ossigeno in acqua, " dice Wagner. "Ma siamo riusciti a decifrare il meccanismo." Lo studio è una collaborazione di scienziati del Max Planck Institute for Marine Microbiology, l'Istituto Max Planck per la microbiologia terrestre, l'Istituto Paul Scherrer, l'Istituto di ricerca interdisciplinare di Grenoble e la European Synchrotron Radiation Facility.
L'ossigeno è bloccato dentro
Il meccanismo, i ricercatori hanno rivelato, ha un requisito importante:l'ossigeno è molto reattivo, quindi è fondamentale che la reazione sia controllata correttamente dall'enzima e che nessun solvente galleggi. Altrimenti l'ossigeno potrebbe trasformarsi accidentalmente in superossido e uccidere l'anaerobio. Il trucco dell'enzima F420-ossidasi consiste nell'utilizzare un canale del gas e un sistema di gating. La molecola di ossigeno viene prima incanalata nell'apposito canale in un'apposita cavità catalitica anidra contenente ferro. Quindi il ferro trasforma l'ossigeno in acqua che verrà rilasciata da un meccanismo di controllo. Per questo la cavità inizia a muoversi e si apre una piccola "porta". Grazie al movimento, l'acqua appena generata viene trasportata all'esterno. La cavità vuota si richiude ed è disponibile per la successiva molecola di ossigeno.
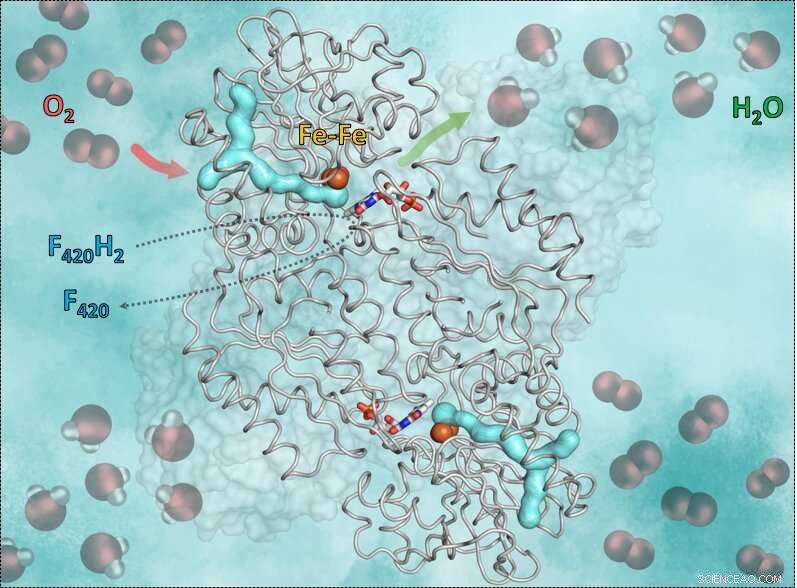
Questo grafico mostra l'enzima F420H2-Ossidasi e il modo in cui funziona. La parte a forma di y ciano è il canale del gas. La freccia rossa mostra l'ingresso dell'ossigeno nella cavità catalitica contenente il ferro. La freccia verde simboleggia l'uscita dall'acqua. Ancora, i bastoncini blu-rossi al centro mostrano la flavina (FMN) che accetta gli elettroni dal coenzima ridotto F420, che porta l'idrogeno necessario per convertire l'ossigeno in acqua. Crediti:S. Engilberge e T. Wagner
Per ottenere informazioni su questo meccanismo, gli scienziati hanno utilizzato la cristallografia a raggi X. Per prima cosa ottennero la struttura cristallina senza ossigeno, dove potevano vedere la cavità catalitica anidra isolata dal solvente. Quindi, gasarono i cristalli di enzimi con il gas inerte krypton, quale, a differenza dell'ossigeno, può essere reso visibile dai raggi X. Successivamente hanno irradiato i cristalli dell'enzima e sono stati in grado di rilevare gli atomi di krypton che mostrano il canale del gas che conduce alla cavità catalitica. La proteina flavodiiron e il suo canale sono conservati non solo nei metanogeni, ma anche in altri microrganismi come i clostridi (che vivono principalmente nel suolo o nel tubo digerente), nei batteri solforati Desulfovibrio gigas o anche nel parassita intestinale Giardia intestinalis.
Più veloce è, meglio è
"Questa reazione è davvero veloce, ", afferma Sylvain Engilberge del Paul Scherrer Institute e primo autore dello studio accanto a Tristan Wagner. "Questa velocità è anche l'alta importanza della nostra indagine". Enzimi simili come la laccasi sono molto più lenti. "Per future applicazioni di elettrochimica ispirata alla bio processi, dobbiamo imparare di più dalla reazione chimica, struttura e funzione di diversi gruppi di enzimi che riducono l'ossigeno, ", afferma Engilberge. Inoltre, aprirebbe la strada all'ingegneria proteica per convertire un disintossicante O2 ad alta velocità in un dissipatore di elettroni per i processi industriali.
"Il nostro prossimo passo sarebbe capire la diversità della proteina flavodiiron, " dice Tristan Wagner. Alcuni omologhi non prendono di mira l'ossigeno ma il velenoso ossido nitrico, i loro enzimi possono discriminare tra entrambi i gas con elevata specificità. Ma cos'è il filtro selettivo? Il canale del gas? L'ambiente della cavità catalitica? "Sono necessari ulteriori studi per capire come la proteina discrimina ossigeno e ossido nitrico, " aggiunge Wagner. Con tale conoscenza, sarebbe per esempio possibile prevedere dalle informazioni genomiche se una proteina flavodiiron sarebbe uno scavenger di ossigeno o di ossido nitrico.