Credito:Università della California, Los Angeles
Il Tang, Garga, e i gruppi di ricerca di Houk hanno scoperto i catalizzatori proteici naturali (enzimi) che catalizzano la reazione dell'ontano-ene.
Tutti i gruppi fanno parte del Dipartimento di Chimica e Biochimica dell'UCLA. Il Professor Yi Tang è il Professore Cancelliere presso il Dipartimento di Ingegneria Chimica e Biomolecolare dell'UCLA e ricopre anche un incarico congiunto presso il Dipartimento di Bioingegneria. Il professor Ken Houk detiene la cattedra Saul Winstein Distinguished Research in chimica organica e il professor Neil Garg detiene la cattedra Kenneth N. Trueblood Endowed in chimica e biochimica e funge da presidente del dipartimento.
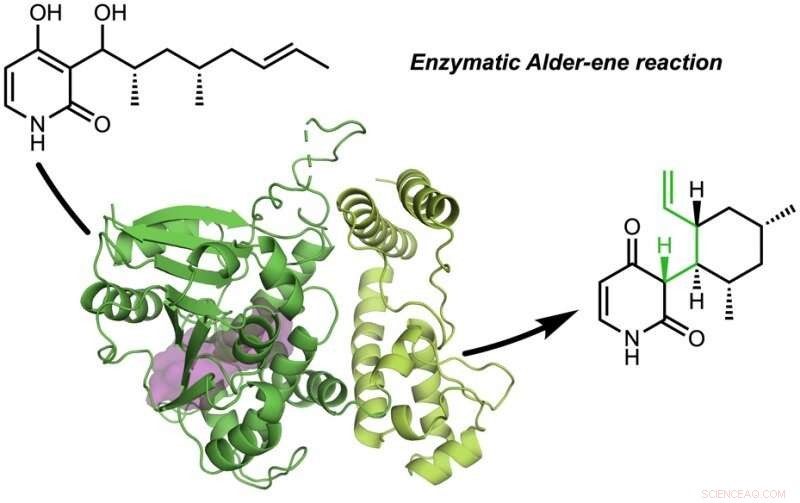
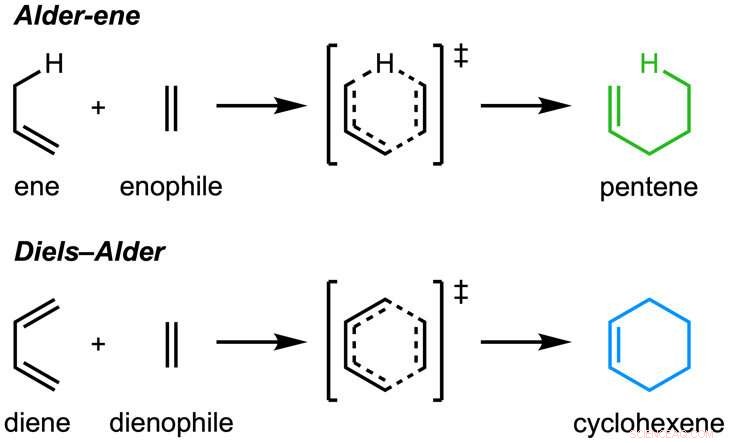
La carta, "Una reazione enzimatica Alder-ene" è stata pubblicata in Natura . La reazione Ontano-ene è stata scoperta nel 1943, ma fino ad ora è stato utilizzato solo per la sintesi chimica in laboratorio. La reazione Alder-ene è un esempio di reazione periciclica e un analogo della ben nota reazione di Diels-Alder. In precedenza, Tang e Houk hanno identificato una nuova classe di enzimi, le periciclasi, per la loro capacità di accelerare le reazioni pericicliche nel metabolismo primario e secondario.
In collaborazione con Jiahai Zhou dello Shanghai Institute of Organic Chemistry, i gruppi Tang-Garg-Houk hanno riportato le strutture e i meccanismi di due gruppi di enzimi che catalizzano una disidratazione stereoselettiva e concomitante reazione periciclica, mostrato di seguito, dove i piccoli simboli come PdxI indicano enzimi naturali (catalizzatori proteici) scoperti dal gruppo Tang. Un gruppo di enzimi catalizza una reazione ontano-ene, e il secondo catalizza reazioni etero-Diels-Alder.
Credito:Università della California, Los Angeles

Credito:Università della California, Los Angeles
L'articolo descrive la sintesi divergente di piridoxatina e asperpiridone A. Partendo dal substrato alcolico, gli enzimi facilitano una disidratazione per formare un intermedio reattivo chinone metide da cui gli scheletri piridoxatina e asperpiridone A possono formarsi mediante reazione Alder-ene o Diels-Alder. Masao Ohashi nel gruppo Tang, e Cooper Jamieson nei gruppi Houk e Tang hanno lavorato insieme per identificare i fattori negli enzimi che controllano quale reazione si verifica. Le previsioni computazionali hanno guidato le modifiche sperimentali che hanno alterato gli enzimi in modo da catalizzare l'altra reazione. Questo tipo di ingegneria proteica promette di influenzare la sintesi di laboratorio di prodotti naturali correlati in futuro.
Credito:Università della California, Los Angeles
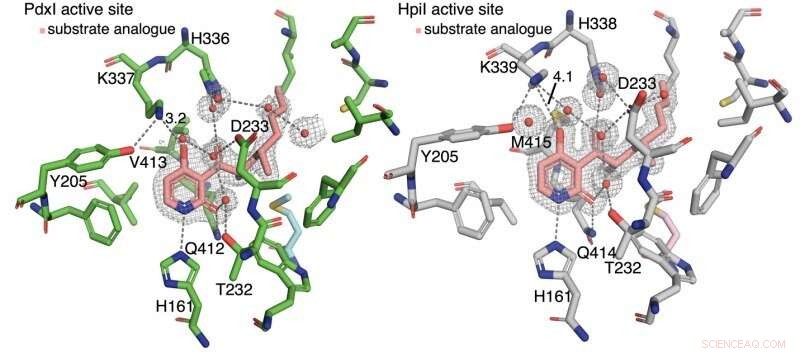
Gli autori hanno scoperto che il legame idrogeno al piridone C4 controlla il tipo di reazione. Negli enzimi PdxI, AdxI, e MdxI, un residuo di lisina (K337) si lega a idrogeno con C4. Questo diminuisce la nucleofilia dell'ossigeno e sfavorevole la reazione etero-Diels-Alder. PdxI, AdxI, e MdxI usano questa strategia per formare selettivamente lo scheletro di piridossina. Enzimi EpiI, Upi, e HpiI bloccano questo legame idrogeno dal verificarsi con un residuo di metionina flessibile (M415) e quindi facilitano la formazione dello scheletro di asperpiridone A. Questa sottile differenza geometrica nei siti attivi produce un cambiamento elettronico piuttosto grande nel substrato e controlla la reazione enzimatica periciclica.