Un diagramma che illustra l'acetilazione dell'enzima elicasi Pif1 Credito:Matthew Bochman e Lata Balakrishnan, Università dell'Indiana Bloomington/IUPUI
Un nuovo studio condotto da scienziati della IUPUI e dell'Università dell'Indiana di Bloomington è il primo a descrivere un meccanismo biochimico che aumenta l'attività di una molecola la cui presenza si osserva in molti tipi di cancro.
La molecola, un enzima chiamato Pif1helicase, svolge un ruolo in molti importanti processi cellulari nel corpo. La regolazione rigorosa di questa proteina è vitale per la stabilità del genoma perché un'attività insufficiente o eccessiva può influenzare l'invecchiamento e le malattie legate all'età, principalmente il cancro. Una comune terapia del cancro, inibitori HDAC, può anche innescare un picco in questo enzima.
"Attualmente, stiamo somministrando alle persone farmaci che aumentano l'attività del Pif senza sapere completamente come influisce su altre parti della cellula che svolgono un ruolo nella stabilità del genoma, " disse Lata Balakrishnan, professore associato di biologia presso la School of Science della IUPUI, chi è co-autore principale dello studio.
"Gli inibitori dell'HDAC sovraregolano alcuni geni di soppressione del tumore, e quindi sono utilizzati in terapie combinate per il trattamento di tumori specifici, ma quando si tratta del loro impatto su altre parti della cellula, fondamentalmente operiamo al buio".
L'altro autore principale dello studio è Matthew Bochman, un professore associato nel Dipartimento di Biochimica Molecolare e Cellulare dell'Università di Bloomington College of Arts and Sciences. Altri coautori sono Christopher Sausen e Onyekachi E. Ononye, dottorato di ricerca studenti nei laboratori di Bochman e Balakrishnan, rispettivamente, al momento dello studio.
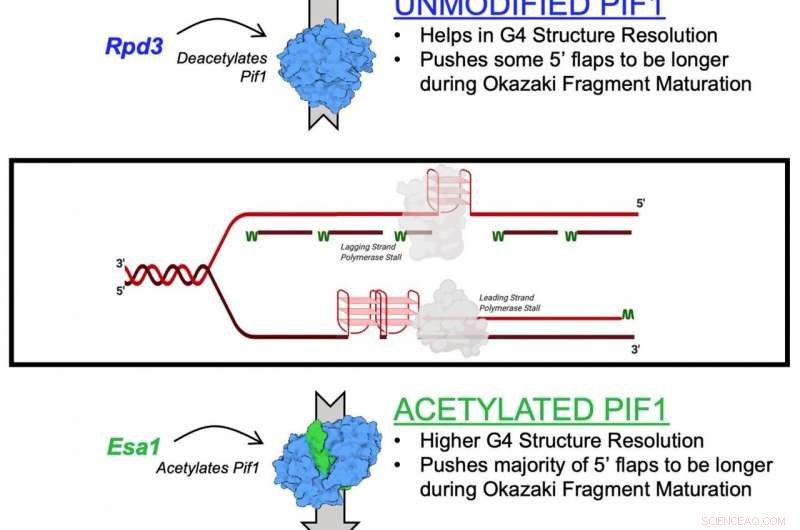
Il meccanismo descritto nello studio è l'effetto dell'acetilazione della lisina su Pif1. L'acetilazione della lisina si verifica quando una piccola molecola chiamata gruppo acetile si lega alla lisina, un amminoacido utilizzato per costruire proteine comuni nel corpo. Questa azione trasforma la lisina da una molecola con carica positiva a una molecola con carica neutra. Questa neutralizzazione può avere un impatto sulla funzione delle proteine, stabilità proteica e interazione proteina-proteina nelle cellule, tra l'altro.
Le elicasi sono conosciute come le "cerniere" genetiche delle cellule perché separano il DNA ai fini della replicazione e riparazione genetica. Aiutano anche a mantenere i telomeri, la struttura alla fine dei cromosomi che si accorciano man mano che le persone invecchiano.
Nel nuovo studio, i ricercatori hanno identificato l'acetilazione della lisina sull'elicasi Pif1 e hanno mostrato che l'aggiunta del gruppo acetile aumenta l'attività della proteina, così come la sua funzione di "decompressione". Hanno anche scoperto che l'acetilazione della lisina cambia la forma, o "conformazione", della proteina Pif1. Credono che questo cambiamento di forma aumenti la quantità di elicasi Pif1.
"L'interazione dinamica dell'aggiunta e della rimozione del gruppo acetile sulla lisina regola un'ampia varietà di proteine all'interno della cellula, " Balakrishnan ha detto. "Le perturbazioni a questo processo possono avere un ruolo nel cancro, invecchiamento, risposte infiammatorie e persino comportamenti legati alla dipendenza”.
"Come classe, le elicasi sono coinvolte in molti processi necessari per l'integrità del genoma, " Ha aggiunto Bochman. "Qualsiasi fallimento significativo in questi processi è generalmente cancerogeno".
I dettagli precisi dell'acetilazione della lisina in Pif1, il suo effetto sulla forma dell'enzima e il conseguente impatto sull'attività dell'elicasi ha richiesto quasi cinque anni per essere osservato e riportato. Lo studio, svolto in parallelo su due campus IU, è stato reso possibile dalle competenze complementari dei principali scienziati. Come biochimico che ha precedentemente studiato l'acetilazione della lisina in altre proteine, Balakrishnan è stato in grado di isolare Pif1 in vitro per osservare la sua risposta alle reazioni chimiche in una provetta. In contrasto, come genetista che lavora nel lievito come organismo modello per studiare Pif1, Bochman è stato in grado di modificare le cellule in vivo per osservare le reazioni che si verificano in un organismo vivente.
"La capacità di osservare queste reazioni in una cellula vivente è spesso più rilevante, ma è anche molto più disordinato, "Ha detto Balakrishnan. "I nostri esperimenti si informavano costantemente l'un l'altro su dove andare dopo".
Guardando al futuro, Bochman ha affermato che la conoscenza complessa dei processi cellulari, come l'acetilazione della lisina, svolgerà sempre più un ruolo nella terapia personalizzata.
"Se si sequenzia il tumore di un paziente, puoi mettere a punto i farmaci per colpire enzimi molto specifici, " ha detto. "Invece di un farmaco che colpisce ampiamente l'intera cellula, sarà possibile adottare un approccio mirato che riduca i potenziali effetti collaterali. Questo livello di personalizzazione è davvero il futuro della biologia e della medicina del cancro".