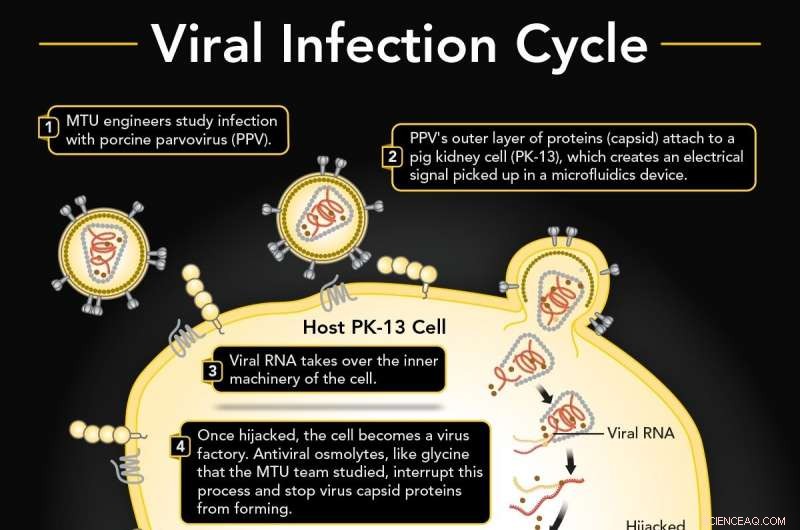
1. Il parvovirus suino (PPV) infetta una cellula renale di maiale (PK-13). 2. Il PPV si lega a PK-13 usando il suo strato esterno di proteine (capside), che può essere rilevato in un dispositivo di microfluidica. 3. L'RNA virale dirotta il macchinario interno della cellula per produrre più virus. 4. L'osmolita antivirale glicina probabilmente interrompe la formazione del capside. 5. Se ininterrotto, le repliche virali esplodono attraverso la membrana cellulare. 6. C'è uno spostamento nel segnale elettrico se è presente glicina che è diverso da una normale cellula infetta. Credito:Università tecnologica del Michigan
Un virus si attacca a una cellula, apre la serratura ed entra, quindi prende il controllo della produzione genetica e pompa molte versioni di se stesso che esplodono attraverso la parete cellulare.
Prendi i tuoi popcorn. Ingegneri e virologi hanno un nuovo modo di osservare l'attenuazione dell'infezione virale.
La tecnica utilizza la microfluidica, il controllo submillimetrico dei fluidi all'interno di un preciso, struttura geometrica. Su quello che è fondamentalmente un vetrino da microscopio truccato, gli ingegneri chimici della Michigan Technological University sono stati in grado di manipolare i virus in un dispositivo microfluidico utilizzando campi elettrici. Lo studio, pubblicato questa estate in Langmuir , esamina i cambiamenti nella membrana cellulare e offre ai ricercatori un'idea più chiara di come funzionano gli antivirali in una cellula per fermare la diffusione dell'infezione.
L'infezione virale inizia con il capside
I virus trasportano un guscio esterno di proteine chiamato capside. Le proteine agiscono come un grimaldello, attaccandosi e facendo leva per aprire la membrana di una cellula. Il virus quindi dirotta il funzionamento interno della cellula, costringendolo a produrre in serie il materiale genetico del virus e a costruirne molti, molte repliche virali. Proprio come i chicchi di popcorn che spingono via il coperchio di una pentola troppo piena, i nuovi virus esplodono attraverso la parete cellulare. E il ciclo continua con altri lockpick di virus a piede libero.
"Se si considerano le tecniche tradizionali, l'etichettatura fluorescente per le diverse fasi, immagini, verifica della vitalità:il punto è sapere quando la membrana è compromessa, " ha detto Adrienne Minerick, coautore dello studio, preside del College of Computing e professore di ingegneria chimica. "Il problema è che queste tecniche sono una misura indiretta. I nostri strumenti guardano alla distribuzione della carica, quindi è fortemente focalizzato su ciò che sta accadendo tra la membrana cellulare e la superficie del virus. Abbiamo scoperto con maggiore risoluzione quando il virus entra effettivamente nella cellula".
Dielettroforesi:conversazione carica
Osservare il ciclo dell'infezione virale e monitorarne le fasi è fondamentale per lo sviluppo di nuovi farmaci antivirali e per comprendere meglio come si diffonde un virus. La dielettroforesi si verifica quando le cellule polarizzabili vengono spinte in un campo elettrico non uniforme. Il movimento di queste cellule è utile per diagnosticare malattie, gruppo sanguigno, studiando il cancro e molte altre applicazioni biomediche. Quando applicato allo studio dell'infezione virale, è importante notare che i virus hanno una carica superficiale, quindi all'interno dello spazio confinato in un dispositivo microfluidico, la dielettroforesi rivela la conversazione elettrica tra il capside virale e le proteine di una membrana cellulare.
"Abbiamo studiato l'interazione tra virus e cellula in relazione al tempo utilizzando dispositivi microfluidici, " disse Sanaz Habibi, che ha guidato lo studio come studente di dottorato in ingegneria chimica presso la Michigan Tech. "Abbiamo dimostrato di poter vedere interazioni virus-cellule dipendenti dal tempo nel campo elettrico".
Guardare un'infezione virale accadere in tempo reale è come un incrocio tra un film horror di zombi, asciugatura della vernice e un'epopea di Bollywood a ripetizione. Le cellule nel dispositivo microfluidico danzano intorno, spostandosi in modelli distinti con un segnale musicale dielettrico. Ci deve essere il giusto rapporto tra virus e cellule per vedere l'infezione accadere, e non accade rapidamente. L'esperimento di Habibi si svolge in turni di 10 ore, seguendo le scene iniziali dell'attaccamento virale, una lunga parentesi di intrusione, e infine il tragico finale quando i nuovi virus scoppiano, distruggendo la cellula nel processo.
Prima che esplodano, le membrane cellulari formano strutture chiamate blebs, che modificano il segnale elettrico misurato nel dispositivo microfluidico. Ciò significa che le misurazioni della dielettroforesi garantiscono una comprensione ad alta risoluzione degli spostamenti elettrici che si verificano sulla superficie della cellula durante l'intero ciclo.
Entra nell'Osmolita
Le infezioni virali sono al primo posto in questo momento, ma non tutti i virus sono uguali. Mentre i dispositivi microfluidici che utilizzano la dielettroforesi potrebbero un giorno essere utilizzati in loco, test rapidi per malattie virali come COVID-19, il team di Michigan Tech si è concentrato su un virus ben noto e attentamente studiato, il parvovirus suino (PPV), che infetta le cellule renali nei suini.
Ma poi il team ha voluto spingersi oltre:hanno aggiunto l'osmolita glicina, un intervento importante che i loro collaboratori studiano nella chimica della superficie virale e nello sviluppo di vaccini.
"Utilizzando il nostro sistema, potremmo mostrare il comportamento dipendente dal tempo del virus e della membrana cellulare. Poi abbiamo aggiunto l'osmolita, che può agire come un composto antivirale, Habibi ha spiegato. "Pensavamo di fermare l'interazione. Anziché, sembrava che l'interazione continuasse all'inizio, ma poi i nuovi virus non potevano uscire dalla cellula".
Questo perché la glicina probabilmente interrompe la nuova formazione del capside per i virus replicati all'interno della cellula stessa. Mentre quella parte specifica della danza virale avviene dietro la cortina della parete cellulare, le misurazioni dielettriche mostrano uno spostamento tra un ciclo infetto in cui avviene la formazione del capside e una cellula infetta in cui la formazione del capside è interrotta dalla glicina. Questa differenza di carica elettrica indica che la glicina impedisce ai nuovi virus di formare capsidi e impedisce agli aspiranti scassinatori virali di colpire i loro bersagli.
"Quando lavori con particelle e organismi così piccoli, quando sei in grado di vedere questo processo accadere in tempo reale, è gratificante tenere traccia di questi cambiamenti, "ha detto Habibi.
Questa nuova visione delle interazioni tra capsidi virali e membrane cellulari potrebbe accelerare i test e la caratterizzazione dei virus, eliminando la tecnologia di imaging costosa e dispendiosa in termini di tempo. Forse in una futura pandemia, ci sarà un punto di cura, dispositivi portatili per diagnosticare le infezioni virali e possiamo sperare che i laboratori medici siano dotati di altri dispositivi microfluidici in grado di esaminare rapidamente e rivelare i farmaci antivirali più efficaci.