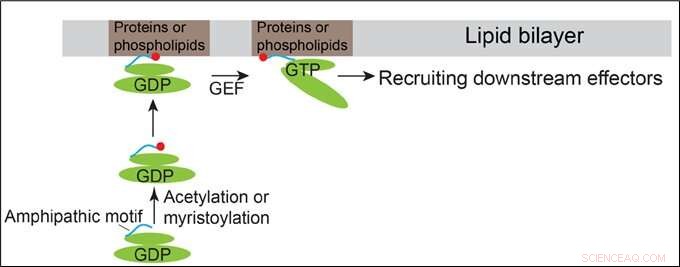
Modello che dimostra come Arfrp1 e Arl14 vengono reclutati nelle membrane. Attestazione:HKUST
Le piccole GTPasi della famiglia del fattore di ribosilazione ADP (Arf) sono iniziatori chiave di vari processi fisiologici tra cui secrezione, endocitosi, fagocitosi e trasduzione del segnale. Le proteine della famiglia Arf hanno la funzione di mediare il reclutamento di effettori citosolici in specifici compartimenti subcellulari. Questo processo facilita gli effettori Arf per eseguire il riconoscimento del carico, modificazione lipidica o altre funzioni cellulari.
Il blocco delle attività delle proteine della famiglia Arf inibisce la secrezione di importanti molecole dalla cellula e inibisce anche l'assorbimento cellulare dei nutrienti. I difetti negli Arf o nelle loro proteine regolatrici sono correlati a varie malattie ereditarie, inclusa la disabilità intellettiva legata all'X (XLID), sindrome di Joubert, Sindrome di Bardet-Biedl e disfunzione delle ciglia. Così, lo studio dei meccanismi molecolari delle attività intracellulari regolate dall'Arf rappresenta un'opportunità per comprendere l'eziologia di queste malattie e sviluppare nuove strategie terapeutiche.
Le proteine della famiglia Arf si alternano tra uno stato inattivo legato al PIL e uno stato attivo legato al GTP. Hanno organizzazioni strutturali simili contenenti un motivo di elica anfipatica N-terminale e i domini di commutazione. I domini di commutazione delle proteine Arf legano direttamente i loro corrispondenti fattori di scambio di nucleotidi guanidinici (GEF), consentendo così alle proteine Arf di legarsi al GTP. Si ritiene generalmente che il reclutamento di membrana delle proteine Arf sia iniziato da cambiamenti conformazionali delle proteine Arf indotti dal legame GTP.
Oltre a questo meccanismo convenzionale, Il professor Guo e il suo team hanno scoperto che i motivi anfipatici N-terminali della proteina della famiglia Arf localizzata nel Golgi, Arfrp1, e la proteina della famiglia Arf localizzata nell'endosoma e nella membrana plasmatica, Arl14, sono sufficienti per determinare localizzazioni subcellulari specifiche in modo GTP-indipendente. Lo scambio dei motivi dell'elica anfipatica tra queste due proteine Arf provoca lo scambio delle loro localizzazioni. La determinazione spaziale mediata dall'elica di Arfrp1 richiede il suo partner di legame Sys1. Inoltre, lo studio indica che l'acetilazione dell'elica Arfrp1 e la miristoilazione dell'elica Arl14 sono importanti per la specifica localizzazione subcellulare. Un modello proposto rappresenta il reclutamento di membrana di Arfrp1 e Arl14.
Questo studio scopre nuove intuizioni sul meccanismo molecolare che regola l'associazione di membrana di alcune proteine Arf, suggerendo che l'associazione di membrana e l'attivazione di alcune proteine Arf sono disaccoppiate. Questo studio offre anche nuovi motivi brevi per indirizzare le proteine a specifiche localizzazioni intracellulari.
I risultati sono stati recentemente pubblicati sulla rivista scientifica the Journal of Biological Chemistry .