Tavola periodica che mostra gli elementi che potrebbero presentare metallofilia. Credito:Università di Hong Kong
Un gruppo di ricerca guidato dal professor Chi-Ming Che e dal dottor Jun Yang, dalla Divisione di Ricerca per la Chimica e dal Dipartimento di Chimica della Facoltà di Scienze dell'Università di Hong Kong, ha risolto un problema fondamentale di lunga data nel campo dell'interazione metallo-metallo a guscio chiuso. Questo lavoro è stato pubblicato sulla rivista Atti dell'Accademia Nazionale delle Scienze (PNAS) .
Interazione metallo-metallo a guscio chiuso, noto anche come metallofilia, ha un enorme impatto in diversi campi della chimica, come la chimica supramolecolare e la chimica organometallica. I primi rapporti sulla metallofilia potrebbero essere fatti risalire agli anni '70. Molti dei principali chimici teorici di tutto il mondo hanno dato contributi nel campo, come Roald Hoffmann (1981 Premio Nobel per la Chimica), Pekka Pyykkӧ, ecc. La metallofilia è importante nella fabbricazione di autoassemblaggi mediante complessi di metalli di transizione, che ha dimostrato profonde applicazioni nei semiconduttori organici, materiali biorilevanti e optoelettronici funzionali.
Andare oltre la saggezza convenzionale
Il termine "metallofilia" ha origine dall'Europa ed è stato ampiamente utilizzato dai chimici come principio guida negli studi di progettazione molecolare e per razionalizzare le proprietà spettroscopiche dei complessi di metalli di transizione. Fino ad ora, il consenso generale sulla metallofilia nella comunità accademica è "attraente, " che è stato concepito per derivare dall'ibridazione orbitale e/o dall'effetto relativistico dell'atomo di metalli pesanti, come l'oro o il platino (metallo della terza fila nella tabella degli elementi). Insieme al Professor Che e al Dr. Yang, Il dottor Qingyun Wan e i suoi collaboratori hanno messo in dubbio la saggezza convenzionale dei chimici della coordinazione, concludendo che la metallofilia non è un'interazione attraente nel complesso organometallico, ma in realtà è di natura ripugnante a causa della forte repulsione di M-M' Pauli.
Hanno eseguito una ricerca combinata teorica e sperimentale sulla metallofilia e hanno osservato una forte repulsione M-M' Pauli in complessi organometallici con configurazioni elettroniche a guscio chiuso, che fornirà una nuova prospettiva teorica sulla possibilità di realizzare nuovi materiali supramolecolari con complessi economici di metalli di transizione ricchi di terra, come quello del palladio o dell'argento o del nichel (metalli di 1° o 2° fila nella tavola elementare). È anche un risultato cruciale nella comprensione fondamentale delle interazioni intermolecolari deboli.
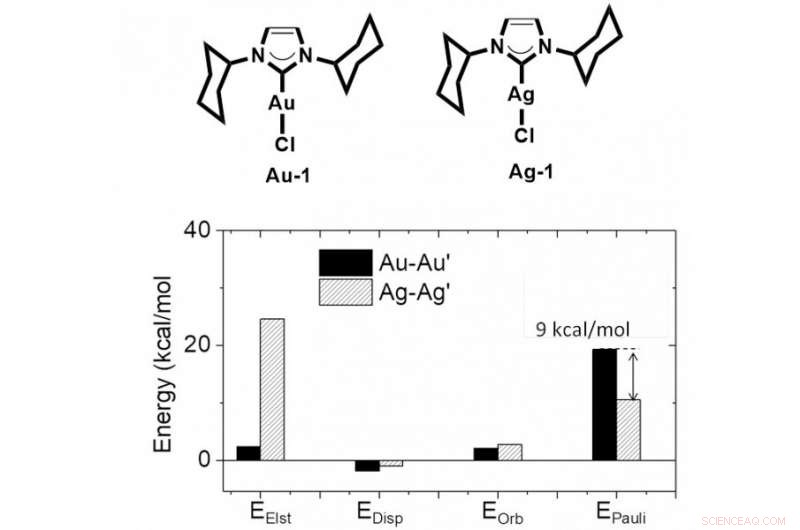
Struttura chimica del complesso Au (Element Gold) e Ag (Element Silver), e i risultati del calcolo mostrano una repulsione Au-Au Pauli più forte della repulsione Ag-Ag Pauli. Credito:Università di Hong Kong
Background e risultati
Nel micromondo delle piccole molecole, ci sono molti tipi di interazioni. La metallofilia descrive l'interazione tra gli atomi di metallo come avente configurazioni elettroniche a guscio chiuso. All'inizio degli anni Settanta, i chimici hanno osservato un fenomeno interessante secondo cui due atomi di metallo a guscio chiuso potrebbero formare una breve distanza metallo-metallo. È stata proposta una speciale "attrazione" tra due atomi di metallo, spingendo due atomi di metallo che si avvicinano. Molti modelli teorici sono stati sollevati per spiegare tale attaccamento, come il modello di ibridazione orbitale o l'effetto relativistico del metallo pesante. Però, questi modelli teorici sono in conflitto con alcune osservazioni sperimentali, come la distanza Ag-Ag relativamente più breve nei complessi Ag rispetto alla distanza Au-Au negli analoghi Au. Così, questo problema è rimasto a lungo controverso e ha sempre afflitto i chimici inorganici e teorici.
I ricercatori di HKU hanno utilizzato metodi di calcolo di alto livello e tecniche sperimentali per indagare su un problema così difficile, e ha dimostrato che la metallofilia è di natura repulsiva a causa della forte repulsione M-M' Pauli. Hanno concluso che l'ibridazione orbitale e l'effetto relativistico avrebbero rafforzato la repulsione metallo-metallo di Pauli quando si formava uno stretto contatto metallo-metallo. La dispersione intermolecolare e l'interazione elettrostatica controbilanciano la repulsione metallo-metallo, portando a una breve distanza metallo-metallo. Questo modello teorico potrebbe spiegare bene perché la distanza Ag-Ag è più corta della distanza Au-Au, a causa della più debole repulsione Ag-Ag Pauli che è indotta da una minore ibridazione orbitale nel complesso Ag.
Da una stima conservativa, erano più di 5, 000 articoli pubblicati in letteratura relativi alla "metalfilicità attraente". L'affermazione di "metalfilicità repulsiva" è stata proposta per la prima volta dal gruppo di ricerca nella loro recente pubblicazione PNAS. Questo lavoro è stato riconosciuto anche dal professor Harry Gray del Caltech, che ha ricevuto il Premio Wolf per la Chimica nel 2004, uno dei premi più onorevoli del settore.