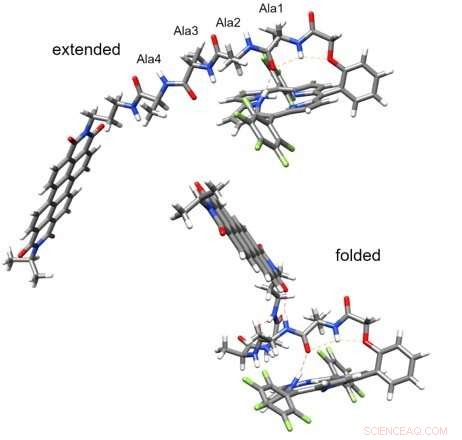
Il peptide esteso (in alto) non media il trasferimento di carica (trasferimento di carica rilevabile)/ Il peptide ripiegato (in basso) media il trasferimento di carica in picosecondi lungo i legami idrogeno tra il donatore e l'accettore (i legami idrogeno sono indicati con linee tratteggiate rosse sottili). Attestazione:Valentine Vullev
Flussi di energia biologica, come nella fotosintesi e nella respirazione, dipendono dal trasferimento di elettroni da una molecola all'altra. Nonostante la sua importanza per sostenere la vita, fattori che regolano la velocità di trasferimento degli elettroni, soprattutto su lunghe distanze, non sono ben compresi perché i sistemi che mediano tali processi ultraveloci sono molto complessi. Una migliore comprensione delle velocità di trasferimento degli elettroni aiuterebbe gli scienziati a migliorare le trasformazioni chimiche, conversione di energia, dispositivi elettronici, e tecnologie fotoniche.
Ora, un team internazionale di ricercatori guidati da UC Riverside ha osservato il trasferimento di carica in picosecondi mediato dai legami idrogeno nei peptidi. Un picosecondo è un trilionesimo di secondo. Come analoghi a catena corta delle proteine, elementi costitutivi di fondamentale importanza per gli organismi viventi, i peptidi sono catene di amminoacidi legati chimicamente. La scoperta mostra il ruolo dei legami idrogeno nel trasferimento di elettroni. I risultati sono pubblicati in Atti dell'Accademia Nazionale delle Scienze .
Valentino Vullev, un professore di bioingegneria presso il Marlan and Rosemary Bourns College of Engineering di UC Riverside, insieme a Daniel Gryko dell'Accademia polacca delle scienze, e Harry Gray del California Institute of Technology, ha guidato un team che ha scoperto un trasferimento di elettroni insolitamente ultraveloce da un donatore a una molecola accettore collegata a linker oligopeptidici che estendono fino a 20 legami covalenti. Il trasferimento di elettroni di solito richiede un microsecondo, o un milionesimo di secondo, in peptidi con distanze di legame così lunghe.
I ricercatori sono stati sorpresi di osservare il trasferimento di elettroni al picosecondo, una velocità 1 milione di volte più veloce di quanto precedentemente noto per tali sistemi.
"Non dovrebbe funzionare, ma lo fa, " Ha detto Vullev. "Il trasferimento di carica al picosecondo che abbiamo osservato contraddice la biologia strutturale, assumendo la distribuzione casuale prevista delle strutture delle catene peptidiche flessibili."
Il team ha scelto molecole donatrici e recettori legate da brevi peptidi che hanno scoperto assumono in realtà strutture ben definite stabilizzate da legami idrogeno. Ulteriori analisi hanno rivelato che i legami idrogeno all'interno di ciascuna molecola hanno portato il donatore e l'accettore vicini l'uno all'altro in un'architettura molecolare a forma di scorpione, consentendo il trasferimento di elettroni al picosecondo.
"Questo design rivoluzionario dimostra che i peptidi corti possono non solo assumere conformazioni secondarie ben definite quando modellati da componenti organici, ma anche fornire una rete di legami idrogeno che può mediare il trasferimento di elettroni con efficienze insolitamente elevate, " Vullev ha detto. "Il nostro lavoro fornisce paradigmi senza precedenti per la progettazione e lo sviluppo di percorsi di trasferimento di carica lungo ponti flessibili, così come approfondimenti sui motivi strutturali per mediare il trasferimento di elettroni nelle proteine".
I risultati potrebbero portare a progressi nell'immagazzinamento dell'energia e stimolare lo sviluppo di elettronica organica che utilizza polimeri conduttori invece di minerali conduttori.
"Uno degli aspetti più eccitanti e appaganti del lavorare nel nostro gruppo è essere in prima linea in tali scoperte e osservare questi risultati spettacolari, " ha detto il co-autore John Clark, uno studente di dottorato nel laboratorio di Vullev che ha effettuato misurazioni fotochimiche per la ricerca.
La carta, "Ruolo dei legami idrogeno intramolecolari nella promozione del flusso di elettroni attraverso coniugati di aminoacidi e oligopeptidi, "