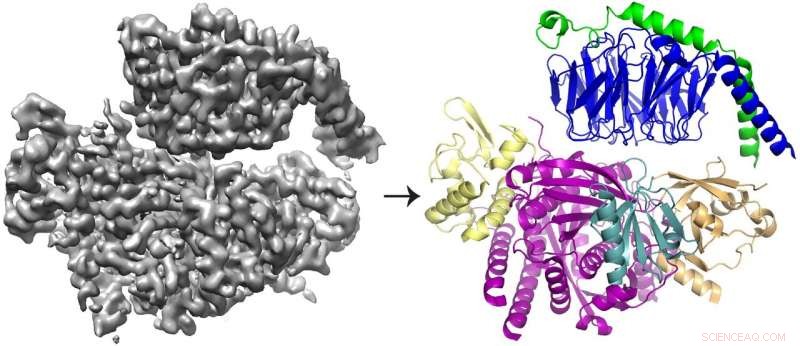
La ricostruzione 3D crio-EM (a sinistra) della proteina P-Rex1 legata a Gβγ e il modello proteico (a destra) che mostra che Gβγ (in alto; blu e verde) si lega a un compatto, superficie multidominio su P-Rex1 (in basso; giallo, magenta, verde acqua e oro). Credito:Jennifer Cash, Istituto di scienze della vita dell'UM.
Quando le cellule del nostro corpo hanno bisogno di muoversi, per attaccare un'infezione o guarire una ferita, per esempio, le proteine cellulari inviano e ricevono una cascata di segnali che indirizzano le cellule nel posto giusto al momento giusto. È un processo che le cellule cancerose possono dirottare per diffondersi a nuovi tessuti e organi.
Ora, un team di ricercatori guidato dall'Istituto di scienze della vita dell'Università del Michigan ha fatto luce su un fattore chiave di questo processo. Le scoperte, prevista per la pubblicazione il 16 ottobre in Progressi scientifici , offrono importanti spunti sulla migrazione cellulare non solo in condizioni di salute normali, ma anche al seno, prostata e altri tipi di cancro.
I ricercatori hanno specificamente sondato una proteina chiamata P-Rex1 (fosfatidilinositolo 3, 4, Scambiatore Rac 5-trifosfato-dipendente 1), che si attiva quando si lega ad un'altra proteina, Gbg. Nonostante la scoperta del P-Rex1 più di 15 anni fa, esattamente come le due proteine interagiscono e come questa interazione porti al movimento cellulare è rimasto poco compreso.
Utilizzando una combinazione di biologia strutturale e tecniche di biochimica, i ricercatori hanno rivelato la struttura del P-Rex1 legato a Gbg, fornendo un'istantanea di come si svolge questo intricato processo di attivazione.
"Conoscere la struttura di questo complesso proteico fornisce dettagli meccanicistici che ci permettono di capire come è regolato, " ha detto Jennifer Cash, Ricercatore LSI e autore principale dello studio. "E quando capiamo come è regolato, possiamo iniziare a pensare a come modificare quella regolazione e inibire la segnalazione del P-Rex1 nei tumori".
Il team ha scoperto che Gbg si lega a un'ampia superficie su P-Rex1 composta da diversi domini proteici. Studi precedenti offrivano argomenti contrastanti su quale dominio (o domini) legasse Gbg. Ma questo ultimo studio è stato in grado di risolvere il conflitto prendendo una visione più ampia della proteina, utilizzando tecnologie più recenti.
"Volevamo esaminare l'enzima nel suo insieme e per farlo, avevamo davvero bisogno di passare alla crio-EM, "ha detto John Tesmer, professore di scienze biologiche alla Purdue University e uno degli autori senior dello studio.
Crio-EM, o criomicroscopia elettronica, consente ai ricercatori di studiare proteine che non possono essere visualizzate utilizzando altre tecniche di biologia strutturale, come il complesso, struttura intrecciata di P-Rex1. Il processo prevede il congelamento delle proteine in un sottile strato d'acqua e l'utilizzo di elettroni per catturare immagini della loro forma. Viene quindi calcolata la media di centinaia di migliaia di immagini per creare una struttura 3D.
Oltre a chiarire come Gbg si lega e attiva P-Rex1, queste nuove scoperte rappresentano un'importante pietra di paragone nello sviluppo della crio-EM, disse Michele Cianfrocco, Professore assistente della LSI e autore senior dello studio.
La maggior parte delle strutture determinate con cryo-EM sono più grandi, molecole simmetriche. I risultati per P-Rex1, in contrasto, rappresentano una struttura ad alta risoluzione della più piccola proteina asimmetrica ottenuta attraverso la crio-EM fino ad oggi. Per di più, un grande dominio in P-Rex1 ha una struttura o piega che non era stata precedentemente identificata in nessun'altra proteina di mammifero, richiedendo al team di costruirlo pezzo per pezzo, un compito difficile con i dati crio-EM.
"Cryo-EM è ancora un campo relativamente nuovo, e le persone sono davvero interessate a sapere fino a che punto possono essere spinti i suoi limiti, " disse Cianfrocco, che è anche assistente professore di chimica biologica presso la U-M Medical School.
Gli articoli di Science Advances sono intitolati "Struttura di microscopia crioelettronica e analisi dello scaffold di segnalazione P-Rex1-Gbg".