Un interruttore dipendente dal potenziale aiuta la scissione dell'acqua utilizzando catalizzatori di ossido di cobalto, I ricercatori del Boston College e della Yale University riferiscono sulla rivista Chem. Una piccola carica elettrica guida una reazione di evoluzione dell'ossigeno che utilizza l'acqua per produrre gas idrogeno. Credito: chimica
Utilizzando abbondante cobalto e un approccio sperimentale unico per sondare i modi per accelerare una reazione catalitica lenta per raccogliere l'idrogeno dall'acqua, ricercatori del Boston College e della Yale University hanno scoperto un interruttore meccanicistico nella reazione di evoluzione dell'ossigeno, un passo significativo verso l'ottimizzazione degli elettrocatalizzatori per la scissione dell'acqua per produrre energia pulita.
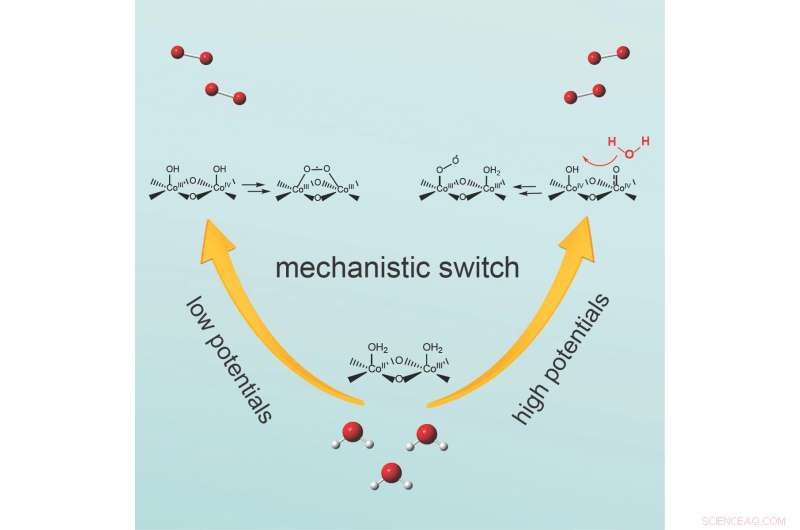
Il meccanismo commuta variando la quantità di tensione, o potenziale applicato, la squadra riporta sul giornale chimica . A potenziale moderato, due atomi di ossigeno legati alla superficie del catalizzatore reagiscono per formare il legame ossigeno-ossigeno. Al contrario, a potenziali più alti, il legame ossigeno-ossigeno è formato da una molecola d'acqua che attacca una specie di ossigeno legata alla superficie.
I risultati mostrano che in questa classe di materiali, dovrebbe essere scelto un elettrocatalizzatore per questa reazione, o ottimizzato, a seconda del regime potenziale in cui si prevede di operare in un reattore. In altre parole, un dato catalizzatore può essere particolarmente efficiente nel promuovere un meccanismo, ma non l'altro.
"Ciò che ci ha sorpreso è stata la rapidità con cui avviene il passaggio da un regime meccanicistico a un altro con potenziale applicato, " ha detto il professore di chimica del Boston College Dunwei Wang, un autore principale del rapporto. "Sono necessari solo circa 100 mV per alternare tra i due meccanismi. È un promemoria di quanto siano sensibili i meccanismi di reazione. Più in generale, il facile interruttore può essere un'altra indicazione di come la fotosintesi può adattarsi ai cambiamenti nell'ambiente di reazione per prestazioni ottimizzate".
I ricercatori hanno lavorato per dividere l'acqua in idrogeno molecolare e ossigeno nel tentativo di fornire abbondante energia rinnovabile sotto forma di gas idrogeno trasportabile e immagazzinabile. La scissione può essere realizzata con elettrocatalisi, un processo in cui le reazioni di evoluzione dell'idrogeno e dell'ossigeno avvengono in compartimenti spazialmente separati su elettrodi. Ciò rende l'elettrocatalisi un mezzo molto promettente per la produzione di gas idrogeno pulito.
Però, la reazione di evoluzione dell'ossigeno (OER) è lenta, disse Wang. Di conseguenza, la velocità della reazione complessiva di scissione dell'acqua è limitata dalla lentezza dell'OER. La reazione deve essere facilitata da catalizzatori, questo è, materiali che promuovono la reazione senza essere essi stessi consumati nel processo. Ad oggi, elettrocatalizzatori economicamente validi per la promozione della reazione di evoluzione dell'ossigeno non sono ancora stati sviluppati. Wang e i suoi colleghi si sono concentrati sull'OER in promettenti elettrocatalizzatori nel tentativo di comprendere meglio i processi di reazione e utilizzare tali intuizioni per progettare elettrocatalizzatori più efficienti e stabili per questa reazione.
Si sono concentrati sulla reazione in una classe di elettrocatalizzatori a base di ossidi di cobalto, un materiale economico e abbondante in terra, attributi che si tradurrebbero in modo efficiente da utilizzare su scala industriale, ha detto Wang.
Nell'ultima decade, vari elettrocatalizzatori a base di ossido di cobalto sono emersi come candidati promettenti per promuovere l'OER. In collaborazione con i colleghi della Yale University, Wang e il suo team hanno studiato l'OER su due tipi di elettrocatalizzatori di ossido di cobalto con tecniche elettrochimiche, spettroscopia ad infrarossi, e teoria del funzionale della densità.
Wang ha affermato che il team ha controllato la concentrazione dell'acqua utilizzando elettroliti acqua-in-sale, che presentano una concentrazione di sale circa dieci volte superiore a quella dell'acqua di mare. Di conseguenza, i ricercatori potrebbero controllare l'attività dell'acqua regolando la quantità di sale nell'elettrolita. Hanno monitorato come la velocità della reazione ha risposto a diverse concentrazioni di acqua. Questo ha rivelato il meccanismo dell'OER su elettrocatalizzatori a base di cobalto, ha detto Wang. Matthias Waegele, coautore e professore associato di chimica della BC, e il suo gruppo di ricerca hanno utilizzato la spettroscopia infrarossa, che si basa sull'interazione della luce infrarossa con le molecole, per rilevare intermedi di reazione dell'OER in condizioni operative.
Sono stati in grado di rilevare un intermedio chiave di reazione, che è stato previsto dai calcoli del chimico di Yale Victor Batista e del suo gruppo di ricerca. Gary Brudvig, un chimico inorganico a Yale, ha anche consigliato il team durante il progetto.
Wang ha detto che il team voleva osservare da vicino la reazione all'evoluzione dell'ossigeno, in particolare la caratteristica che si tratta di un processo graduale, non un singolo evento. L'acqua contiene un solo atomo di ossigeno. Il prodotto dell'OER è ossigeno molecolare, che contiene due atomi di ossigeno. Perciò, durante l'OER si forma un legame ossigeno-ossigeno, ha notato.
Wang ha affermato che i ricercatori in questo campo si sono concentrati su due questioni centrali:come si forma questo legame di ossigeno e in quale fase? Due meccanismi principali sono stati proposti in studi precedenti, tuttavia i ricercatori dovevano ancora stabilire in quali condizioni sperimentali:temperatura, o potenziale dell'elettrodo applicato, per esempio, si forma il legame ossigeno-ossigeno e quale dei meccanismi è quello dominante.
Wang e i suoi colleghi hanno deciso di esaminare da vicino come il potenziale dell'elettrodo applicato determina il meccanismo della fase di formazione del legame ossigeno-ossigeno poiché le reazioni nell'elettrocatalisi sono guidate da un potenziale elettrico applicato al catalizzatore.
I risultati suggeriscono che l'interruttore meccanicistico potrebbe essere generale per gli elettrocatalizzatori a base di ossido, ha detto Wang.
"Siamo molto interessati a sapere se questa osservazione si applica anche ad altri elettrocatalizzatori promettenti, " ha detto. "In particolare, attualmente stiamo lavorando su catalizzatori con centri attivi definiti atomicamente. A differenza degli elettrocatalizzatori a base di cobalto, la cui struttura atomica al centro attivo rimane irrisolta, la nostra nuova piattaforma di studio contiene centri catalitici che sono atomicamente ben definiti. Sarà molto interessante vedere se l'interruttore meccanicistico indotto dal potenziale si verifica anche su quei catalizzatori".