Credito:CC0 Dominio Pubblico
peptidi, che sono brevi stringhe di amminoacidi, svolgono un ruolo vitale nella salute e nell'industria con una vasta gamma di usi medici, inclusi gli antibiotici, farmaci antinfiammatori e antitumorali. Sono utilizzati anche nell'industria cosmetica e per migliorare le prestazioni atletiche. L'alterazione della struttura dei peptidi naturali per produrre composti migliorati è quindi di grande interesse per gli scienziati e l'industria. Ma come funzionano i macchinari che producono questi peptidi non è ancora chiaro.
Il professore associato Max Cryle del Biomedicine Discovery Institute (BDI) della Monash University ha rivelato un aspetto chiave del macchinario peptidico in un articolo pubblicato su Comunicazioni sulla natura oggi che fornisce una chiave per il Santo Graal della reingegnerizzazione dei peptidi.
I risultati faranno avanzare il lavoro del suo laboratorio nella reingegnerizzazione degli antibiotici glicopeptidici per contrastare la pressante minaccia globale rappresentata dalla resistenza antimicrobica, e più in generale per migliorare le proprietà dei peptidi in generale.
"I macchinari per la sintesi di peptidi sono spesso linee di assemblaggio in gran parte modulari, con ogni modulo composto da diverse parti componenti. Cambiando ciò che fai in queste catene di montaggio, questo è, peptidi con nuove bioattività, è un 'Santo Graal' in riprogettazione, Il Professore Associato Cryle ha detto. "Una delle cose che abbiamo cercato di capire in questo studio è stata la provenienza della selettività di questi macchinari:sono molto selettivi per produrre un peptide specifico e capire da dove viene questa specificità è un po' un mistero, " Egli ha detto.
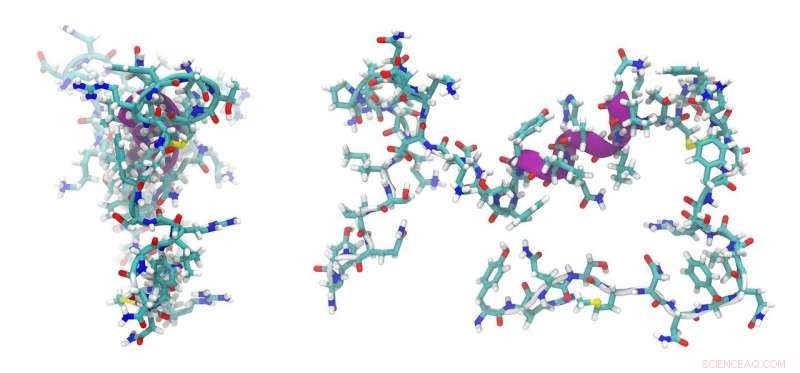
"Siamo stati in grado di caratterizzare strutturalmente una parte di un tale macchinario che genera i collegamenti all'interno dei peptidi in una fase che non è stata determinata in precedenza. Ciò che abbiamo dimostrato è che questi domini responsabili del collegamento degli amminoacidi nei peptidi non svolgono un ruolo generale nella selezione degli amminoacidi durante questo processo".
"Questa è una buona notizia dal punto di vista della reingegnerizzazione perché significa che non dobbiamo preoccuparci di cambiare più parti del macchinario per apportare modifiche a singoli amminoacidi, dobbiamo solo concentrarci sul cambiamento degli elementi costitutivi che entrano ed è abbastanza promettente".
Il Professore Associato Cryle ha guidato un team multidisciplinare di scienziati che hanno arruolato una varietà di tecniche per modellare le strutture peptidiche, incluso l'uso del Sincrotrone australiano per la cristallografia a raggi X insieme a tecniche chimiche e biochimiche. Ha collaborato con gruppi a Canberra, Brisbane e la Germania che hanno aiutato con la modellazione computazionale e la bioinformatica.
"La nostra capacità di comprendere gli enzimi che producono i peptidi naturali è la chiave per la nostra capacità di produrne di migliori per affrontare problemi come la resistenza antimicrobica, " ha detto. "Ora possiamo effettivamente iniziare a pensare a modi per cambiare l'accettazione da parte del macchinario di diversi elementi costitutivi e in questo modo possiamo creare nuovi peptidi con proprietà antibatteriche migliorate, " Egli ha detto.
Nel futuro, una collaborazione con il gruppo del Dr. Evi Stegmann presso l'Università di Tubinga in Germania aiuterà a tradurre i risultati da una soluzione di laboratorio teorica allo sviluppo finale di una produzione su scala commerciale di antibiotici nuovi e migliorati, Egli ha detto.