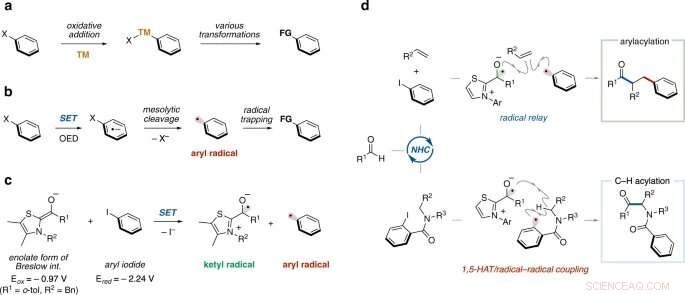
a Addizione ossidativa di alogenuro arilico al metallo di transizione. TM, Metallo di transizione. b Generazione di radicali arilici indotta da donatori di elettroni organici (avanzamento recente). SET, trasferimento di un singolo elettrone. OED, donatore di elettroni organici. c Generazione di radicali arilici mediante catalisi NHC (ipotesi di lavoro). d Arilacilazione di alchene e C(sp 3 )–H acilazione tramite catalisi NHC (questo lavoro). 1, 5-CAPPELLO, 1, Trasferimento di atomi di 5-idrogeno.
Gli alogenuri arilici con un anello benzenico direttamente legato a un atomo di alogeno sono prontamente disponibili e chimicamente stabili, quindi sono usati come fonte di anelli benzenici nella sintesi organica. Per esempio, una reazione chimica che genera un radicale arilico altamente reattivo da un alogenuro arilico utilizzando un composto di stagno tossico è nota da tempo come metodo per fornire un anello benzenico. Negli ultimi anni, sono state sviluppate reazioni chimiche in cui un alogenuro arilico viene ridotto utilizzando un catalizzatore metallico o un fotocatalizzatore seguito dalla scissione del legame tra l'anello benzenico e l'atomo di alogeno per generare un radicale arilico. Però, poiché i metodi precedentemente riportati richiedono sali metallici e/o quantità eccessive di un agente ossidante o di un agente riducente, sono auspicabili reazioni chimiche a minor impatto ambientale.
Il gruppo di ricerca dell'Università di Kanazawa guidato dal Prof. Ohmiya ha sviluppato nuove reazioni chimiche utilizzando catalizzatori organici privi di metalli di nuova concezione per produrre varie sostanze chimiche utili in un modo molto più semplice rispetto ai metodi convenzionali. In questo studio, il gruppo è riuscito a generare radicali arilici da ioduri arilici, un tipo di alogenuro arilico, in condizioni blande senza bisogno di luce o sali metallici, utilizzando un catalizzatore carbene N-eterociclico e i radicali arilici così formati sono stati utilizzati per sintesi organiche.
Un singolo trasferimento di elettroni da un intermedio enolato costituito da un catalizzatore carbene N-eterociclico di tipo tiazolio e un'aldeide ad un ioduro arilico e la successiva scissione del legame tra l'anello benzenico e l'atomo di iodio generano un radicale arilico in maniera catalitica. Considerando il potenziale di ossidazione dell'intermedio enolato (Eox =-0,97 V) e il potenziale di riduzione dell'aril ioduro (Ered =-2,24 V), trasferimento di un singolo elettrone dall'intermedio enolato allo ioduro arilico, cioè riduzione del singolo elettrone, è termodinamicamente sfavorevole. Però, si ritiene che la reazione sia avvenuta per fattori cinetici poiché le due fasi di reazione, cioè 1) trasferimento di un singolo elettrone dall'intermedio enolato allo ioduro arilico e 2) scissione del legame tra l'anello benzenico e l'atomo di iodio, procedere rapidamente. Il radicale arilico generato agisce come fonte dell'anello benzenico, procede la difunzionalizzazione dell'alchene, e si ottiene un chetone sostituito con anello benzenico. Inoltre, utilizzando il radicale arilico generato per la reazione di estrazione dell'idrogeno intramolecolare, procede l'acilazione deidrogenativa dell'ammide, e si può ottenere un composto α-amminochetone. In queste reazioni di conversione molecolare possono essere utilizzati substrati con vari gruppi funzionali. I derivati di prodotti farmaceutici possono anche essere sintetizzati dall'acilazione deidrogenativa delle ammidi.
I risultati di questo studio sono lo sviluppo di una reazione chimica che scinde il legame tra l'anello benzenico di un alogenuro arilico e l'atomo di alogeno utilizzando un catalizzatore organico a basso impatto ambientale, che porta alla generazione di un radicale arilico. Poiché i radicali arilici possono essere facilmente generati dagli alogenuri arilici ampiamente utilizzati nella sintesi organica, questa dovrebbe essere una tecnologia potente per sintetizzare con precisione farmaci medici e agricoli, nonché materiali chimici.