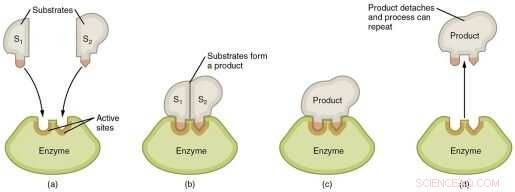
Rappresentazione grafica dei passaggi in una reazione enzimatica. Credito:Wikimedia Commons
Gli enzimi presenti negli organismi viventi hanno un potere catalitico impressionante. Grazie agli enzimi, le reazioni chimiche che sostengono la vita avvengono milioni di volte più velocemente di quanto accadrebbero senza di loro. Gli enzimi accelerano le reazioni contribuendo a ridurre l'energia di attivazione necessaria per avviarle, ma per oltre 70 anni, il modo in cui gli enzimi raggiungono questo obiettivo è stato oggetto di un intenso dibattito.
Il dottor Tor Savidge, professore di patologia e immunologia al Baylor College of Medicine e al Texas Children's Microbiome Center, ei suoi colleghi stanno cambiando il modo di considerare questo vecchio argomento. Nel loro lavoro pubblicato su Chemical Science , hanno studiato le somiglianze e le differenze tra i due meccanismi attualmente in discussione caratterizzando le reazioni catalitiche a livello molecolare dettagliato.
"Al momento, vengono proposti due principali meccanismi di reazione diversi per spiegare il potere catalitico enzimatico", ha detto Savidge. "Uno propone che gli enzimi riducano l'energia di attivazione della reazione attraverso la stabilizzazione degli stati di transizione (TS) e l'altro che lo facciano destabilizzando lo stato fondamentale (GS) degli enzimi. L'idea attuale è che questi meccanismi si escludano a vicenda."
Il primo autore, il dottor Deliang Chen della Gannan Normal University in Cina e i suoi colleghi, hanno adottato un approccio teorico, prendendo in considerazione i risultati precedenti del laboratorio Savidge che dimostrano che le interazioni non covalenti di substrati ed enzimi con l'acqua sono importanti in termini di meccanismo enzimatico reazioni.
"In un ambiente biologico devi considerare l'acqua, che interferirà con le interazioni atomiche molto complesse che si verificano nel sito attivo dell'enzima. Dobbiamo considerarle tutte per capire dove esattamente devi avere interazioni elettrostatiche che sono favorirà quel processo enzimatico", ha detto Savidge. "Quando lo prendi in considerazione, puoi capire come funzionano questi meccanismi."
Le loro analisi hanno portato il team a proporre qualcosa di nuovo:che TS e GS non sono poi così diversi. Usano un meccanismo atomico simile per aumentare la reazione enzimatica in avanti. Il meccanismo coinvolge l'acqua nell'alterare la carica di residui importanti all'interno del sito catalitico in modo da favorire la formazione di uno stato energeticamente favorevole che guida la reazione enzimatica.
"L'importante, nuovo punto qui non è come questo viene raggiunto, ma quando viene raggiunto", ha detto Savidge. "Abbiamo dimostrato che nella stabilizzazione degli stati di transizione, le cariche che guidano la reazione in avanti si formano prima che il substrato entri nel sito attivo. Mentre si trova nello stato fondamentale di destabilizzazione, ciò si verifica anche, ma dopo che il substrato è entrato nel sito attivo."
I ricercatori hanno anche proposto che il meccanismo comune tra TS e GS sia universale; può essere applicato a molte reazioni enzimatiche.
Le loro scoperte hanno importanti implicazioni non solo per aiutare i ricercatori a comprendere meglio il potere catalitico degli enzimi, ma anche per applicazioni pratiche di progettazione di farmaci.
"Utilizziamo i nostri risultati per esplorare più in profondità la catalisi enzimatica microbica in diversi ambienti e per progettare enzimi artificiali", ha affermato Savidge.
Anche Yibao Li, Xun Li, Xiaolin Fan, della Gannan Normal University, e Xuechuan Hong della Wuhan University School of Pharmaceutical Sciences, hanno contribuito a questo lavoro. + Esplora ulteriormente