Astratto grafico. Credito:Catalisi ACS (2022). DOI:10.1021/acscatal.1c05933
I ricercatori del Weizmann Institute of Science e del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) hanno studiato le dinamiche a livello molecolare in gioco quando il metanolo si converte in idrogeno tramite un catalizzatore di rame, con l'intero sistema a pressione e temperatura ambiente . Questo studio, che ha prodotto alcune informazioni sorprendenti sul comportamento del metanolo su diverse superfici di rame, aiuterà i ricercatori a trovare il catalizzatore di rame con le migliori prestazioni per questo processo e, più in generale, approfondire la loro comprensione dei catalizzatori di rame come gruppo.
Il metanolo (un composto di idrogeno, carbonio e ossigeno) è un materiale versatile nell'industria energetica. Può essere utilizzato come combustibile stesso o, come in questa ricerca, per produrre un altro combustibile:l'idrogeno. Il metanolo è uno dei principali candidati per le tecnologie di stoccaggio dell'idrogeno, in particolare nelle applicazioni delle celle a combustibile per automobili. Un liquido a temperatura ambiente, è facile da lavorare e compatibile con l'infrastruttura benzina esistente. Contiene anche una quantità relativamente grande di idrogeno in volume. Ma per produrre idrogeno in modo efficiente, il metanolo richiede l'aiuto di un catalizzatore e una temperatura relativamente alta.
In questo studio, descritto nell'edizione online del 14 giugno 2022 di ACS Catalysis , i ricercatori di Weizmann e Brookhaven hanno studiato un sistema metanolo/rame, legato al vapore di metanolo, o "adsorbito", su una superficie di rame, che non richiedeva una temperatura elevata. Si sono concentrati sulla "decomposizione del metanolo", la più semplice delle quattro reazioni che possono produrre idrogeno dal metanolo. Tra i possibili catalizzatori per la reazione, quelli a base di rame (Cu) sono considerati i più promettenti. Ciò è dovuto a diversi fattori, inclusa la sua struttura elettronica favorevole per l'attività catalitica e il relativo basso costo e sicurezza ambientale rispetto ad altri metalli. Per comprendere meglio il ruolo del Cu, è essenziale che gli scienziati acquisiscano una comprensione approfondita a livello molecolare dell'interazione tra i vapori di metanolo e le superfici di Cu.
I ricercatori di Weizmann e del Center for Functional Nanomaterials (CFN), un DOE Office of Science User Facility di Brookhaven, hanno esaminato tre superfici di Cu per scoprire come il metanolo aderiva ad esse e come si comportava. Queste tre geometrie superficiali sono comunemente studiate come catalizzatori a causa del modo in cui sono disposti gli atomi di Cu, che li rende più disponibili per interagire elettronicamente con altri composti. Il gruppo ha scoperto che il metanolo agisce in modi inaspettati su tutte e tre le superfici.
"La tendenza che abbiamo visto su tutte e tre le superfici è stata che molto metanolo è stato inizialmente adsorbito, poi si è frantumato in diversi componenti che si sono desorbiti. Dopo qualche tempo, la copertura del metanolo ha raggiunto un punto di equilibrio", ha affermato Ashley Head, ricercatrice dell'Interface Gruppo Scienze/Catalisi al CFN e uno degli autori dell'articolo. "Non avevamo visto questo comportamento prima e non ci aspettavamo di farlo."
Per studiarne la dinamica, il gruppo ha utilizzato tecniche di spettroscopia sia a infrarossi (IR) che a raggi X, quest'ultima eseguita presso il CFN.
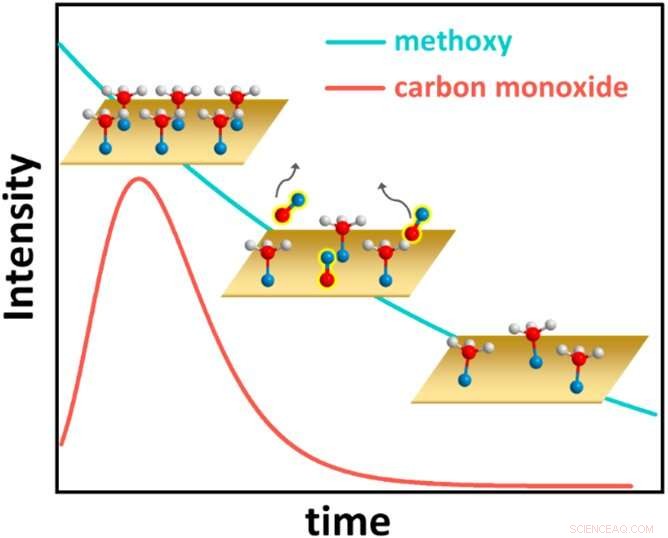
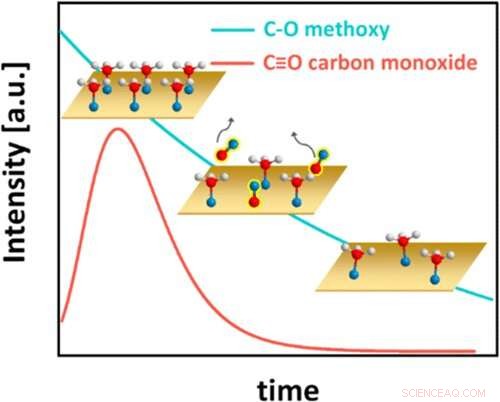
Questa figura illustra il sorprendente comportamento cinetico del sistema metanolo su rame, con atomi di idrogeno mostrati come sfere bianche, atomi di ossigeno come sfere blu e atomi di carbonio come sfere rosse. Inizialmente, il metanolo copre completamente la superficie di rame (Cu) (grafico in alto a sinistra). Ogni molecola di metanolo perde quindi un atomo di idrogeno e forma un legame chimico con il Cu, diventando una specie di carbonio-ossigeno nota come metossi. La metossi superficiale, a sua volta, reagisce formando monossido di carbonio (CO), che si desorbe dalla superficie (grafico centrale, con copertura di CO nel tempo rappresentata dalla linea rossa). La copertura metossidica quindi diminuisce costantemente (grafico in basso a destra e linea blu). Alla fine, viene raggiunta una copertura metossile di equilibrio (non mostrata). Credito:Brookhaven National Laboratory
Il lavoro IR, condotto presso Weizmann, ha fornito informazioni su quali specie chimiche di metanolo si sono formate sulla superficie del Cu misurando come vibrano le molecole. Le vibrazioni specifiche possono essere legate a mescole specifiche.
I dati IR hanno indicato che il metanolo è stato adsorbito pesantemente sul rame e ha formato un legame diretto con il Cu, formando un componente chimico noto come metossi. La copertura metossidica è poi gradualmente diminuita. Questo comportamento è stato riscontrato su tutte e tre le superfici, con variazioni minori.
"Queste dinamiche non concordano con ciò che i modelli consolidati di questo sistema ci dicono che dovremmo vedere", ha affermato Baran Eren, ricercatore presso il Dipartimento di Fisica Chimica e Biologica di Weizmann e autore corrispondente dell'articolo. "Invece, l'evoluzione della copertura metossilica nel tempo segue uno straordinario modello cinetico di adsorbimento."
Ha continuato:"Proponiamo che una forma di breve durata di metanolo legato all'idrogeno sia la fonte dello strato metossilico denso iniziale".
Le informazioni raccolte dai dati IR sono state confermate al CFN, dove il gruppo ha utilizzato la spettroscopia fotoelettronica a raggi X (APXPS). In questa tecnica, i raggi X eccitano gli elettroni in un campione, facendoli liberare. Quegli elettroni espulsi trasportano informazioni preziose. In questo caso, hanno fornito informazioni aggiuntive sul comportamento del metanolo sulla superficie di Cu e sulle condizioni circostanti, in tempo reale. APXPS consente ai ricercatori di calcolare più facilmente le coperture delle molecole sulle superfici rispetto alla spettroscopia IR.
Con il passare del tempo, il metossi in eccesso è stato eliminato man mano che veniva prodotto sempre più idrogeno, lasciando il monossido di carbonio che si de-adsorbiva dal rame come gas. La metossi che era rimasta ha raggiunto un punto di copertura uniforme, un punto di equilibrio. In particolare, la cinetica di questo processo è stata considerevolmente più veloce sulla superficie di Cu più compattata rispetto agli altri due, che sono più compattati.
Nel lavoro futuro, il gruppo prevede di continuare a studiare i sistemi metanolo/Cu per saperne di più sulla loro dinamica e se alcuni di questi comportamenti potrebbero essere trovati in sistemi diversi dal metanolo su Cu. + Esplora ulteriormente