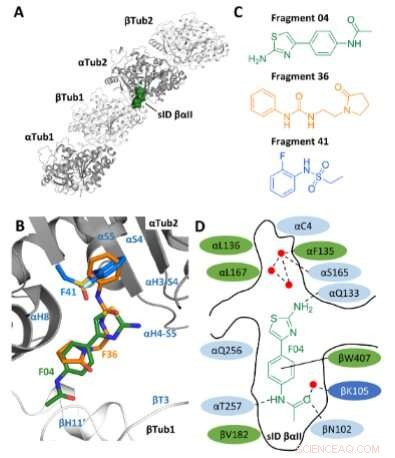
Selezione del frammento. A) Posizione del sito sID βαII (rappresentazione del volume) all'interfaccia interdimerica βTub1-αTub2 del T2 Complesso R-TTL. Per semplicità non vengono mostrate le catene RB3 e TTL. I due monomeri α- e due β-tubulina nel T2 Il complesso R-TTL è mostrato rispettivamente nella rappresentazione a nastro grigio e bianco. B) Sovrapposizione delle pose di rilegatura F04, F36 e F41 (ID PDB 5S4O, 5S5K e 5S5P, rispettivamente). Gli elementi della struttura secondaria della tubulina sono etichettati in blu. Gli atomi di carbonio sono colorati in verde per F04, arancione per il frammento F36 e azzurro per il frammento F41. Gli atomi di azoto sono colorati in blu, gli atomi di ossigeno in rosso, gli atomi di zolfo in giallo e gli atomi di fluoro in verde chiaro. C) Strutture chimiche dei frammenti F04, F36 e F41. D) Rappresentazione schematica di F04 legato al sito sID βαII. I residui che formano il sito di legame sono mostrati in verde per idrofobi, in azzurro per polari e in blu scuro per residui carichi. I residui interagenti αL242 e αL252 non vengono mostrati perché si trovano sotto il ligando. I legami idrogeno sono indicati con interazioni tratteggiate e π-stacking con linee nere continue. I punti rossi rappresentano le molecole d'acqua cristallografiche. Credito:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202204052
I ricercatori del Paul Scherrer Institute PSI e dell'Istituto Italiano di Tecnologia IIT hanno sviluppato una nuova sostanza che disabilita una proteina nello scheletro cellulare, portando alla morte cellulare. In questo modo, sostanze di questo tipo possono prevenire, ad esempio, la crescita di tumori. Per ottenere ciò, i ricercatori hanno combinato un metodo biologico strutturale con la progettazione computazionale di agenti attivi. Lo studio è apparso sulla rivista Angewandte Chemie International Edition .
Lo scheletro cellulare, chiamato anche citoscheletro, pervade tutte le nostre cellule come una rete dinamica di strutture proteiche filiformi. Dà alle cellule la loro forma, aiuta nel trasporto di proteine e componenti cellulari più grandi e svolge un ruolo cruciale nella divisione cellulare. L'elemento fondamentale è la tubulina proteica. Si dispone in strutture tubolari, i filamenti dei microtubuli.
Gli agenti attivi che si attaccano allo scheletro cellulare sono tra i farmaci più efficaci contro il cancro. Bloccano la tubulina e quindi prevengono la divisione cellulare nei tumori. I ricercatori del PSI, in collaborazione con l'Istituto Italiano di Tecnologia di Genova, hanno ora sviluppato un'altra potente sostanza che disabilita la tubulina. L'hanno soprannominato "Todalam".
"Todalam impedisce alla tubulina di organizzarsi sotto forma di filamenti di microtubuli", spiega il primo autore Tobias Mühlethaler, che ha co-progettato e studiato la sostanza come parte della sua ricerca di dottorato al PSI. "La proteina rimane come congelata in una struttura che non si adatta ai microtubuli."
Progettato razionalmente
Esistono in genere due diversi approcci per lo sviluppo di nuovi farmaci:i ricercatori possono testare un numero enorme di molecole per scovare quelle che sembrano promettenti, oppure possono progettare specificamente molecole chimiche che ottengono l'effetto desiderato. I ricercatori del PSI e dell'IIT hanno scelto la seconda strada, che spesso è più difficile.
In tal modo, sono stati in grado di costruire sulle proprie basi, una ricerca in cui avevano già individuato luoghi nella tubulina dove le molecole possono ancorarsi particolarmente bene. Queste sono le cosiddette tasche di legame, di cui hanno trovato 27. Inoltre, i ricercatori hanno identificato 56 frammenti che si legano a questi siti. Anche questo lavoro era stato pubblicato in precedenza in Angewandte Chemie International Edition .
Nell'attuale studio basato su questo lavoro precedente, i ricercatori hanno inizialmente selezionato una tasca legante scoperta di recente sulla tubulina. Hanno usato la progettazione computazionale per combinare le strutture di tre frammenti molecolari, che si agganciano preferenzialmente a questo punto, in un unico composto chimico, e poi lo hanno sintetizzato in laboratorio. "Combinando i tre frammenti in un'unica molecola, speravamo di migliorare l'effetto, poiché la nuova molecola riempie meglio la tasca di legame", afferma Michel Steinmetz, capo del Laboratorio di ricerca biomolecolare del PSI.
Utilizzando le misurazioni presso la Swiss Light Source SLS, i ricercatori hanno verificato quanto bene la molecola si adatta effettivamente alla tasca di rilegatura. In altri due cicli migliorarono la sostanza fino ad arrivare a Todalam. "Con una chimica relativamente semplice, siamo riusciti a ottenere un composto potente", afferma con orgoglio Andrea Prota, uno scienziato del gruppo Steinmetz che ha collaborato a stretto contatto con Mühlethaler.
Semplice struttura chimica
Nelle colture cellulari, i ricercatori hanno dimostrato che Todalam uccide le cellule. Non c'è da stupirsi, dal momento che la tubulina è essenziale per la vita. "Meglio una sostanza si lega a un sito critico nella tubulina, più è tossica per le cellule", spiega Steinmetz. Ciò rende Todalam un promettente punto di partenza per lo sviluppo di un farmaco.
Gli inibitori del citoscheletro attualmente in uso clinico sono sostanze naturali con strutture grandi e complesse e quindi difficili da sintetizzare. Il composto di nuova concezione Todalam, invece, può essere prodotto in una semplice sintesi chimica in laboratorio. "Ciò significa anche che il composto potrebbe essere prodotto in grandi quantità in modo relativamente semplice", sottolinea Steinmetz. + Esplora ulteriormente