Nella maggior parte delle reazioni chimiche industriali, i catalizzatori si combinano con i materiali di partenza e li accompagnano attraverso fasi intermedie fino al prodotto. In chimica, questo percorso è noto come meccanismo di reazione ed è una sorta di scatola nera:all'inizio nessuno sa cosa sta succedendo a livello molecolare.
Se il risultato della reazione in laboratorio non è all'altezza delle aspettative, i chimici ricorrono innanzitutto a tentativi ed errori. In parole povere, modificano la reazione finché non funziona. A volte, tuttavia, vale la pena dare un'occhiata più da vicino al meccanismo di reazione, come mostra la Dott.ssa Nora Jannsen dell'Istituto Leibniz per la catalisi di Rostock utilizzando una reazione modello.
Recentemente ha pubblicato le sue scoperte, ottenute nell'ambito del suo dottorato, nel Journal of the American Chemical Society .
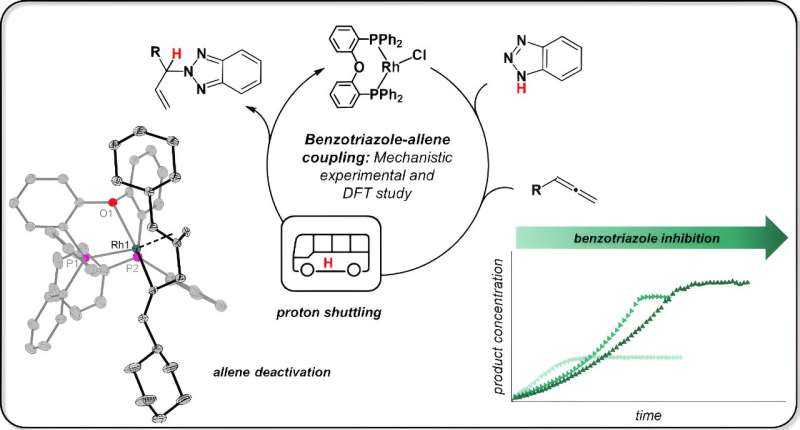
La reazione del modello non sembra spettacolare e, soprattutto, strana all'orecchio dei non addetti ai lavori, spiega Jannsen. "Il benzotriazolo, solitamente un inibitore della corrosione, viene convertito in una nuova sostanza con un allene (l'enfasi qui è sulla seconda sillaba) utilizzando un catalizzatore al rodio." Questo viene quindi chiamato allilbenzotriazolo e può essere utilizzato in una varietà di sintesi. La reazione è stata sviluppata da un gruppo di ricerca guidato dal Prof. Breit dell'Università di Friburgo.
I colleghi di Friburgo sono riusciti a collegare esattamente un "gruppo funzionale" a una posizione molto specifica nel benzotrialzolo. È qui che si trova il legame azoto-idrogeno (N–H), come spiega Jannsen.
I "gruppi funzionali" sono importanti come segmenti molecolari perché sono responsabili dell'effetto specifico, ad esempio farmaceutico.
"Il team di Friburgo voleva collocare un gruppo del genere nel benzotriazolo esattamente dove si trova il legame N–H, e per questo il legame N–H deve cedere", continua Jannsen. I colleghi sono riusciti a farlo. "Ma non capivano su quali basi fossero riusciti a raggiungere questo obiettivo."
Questo è sfortunato. Perché solo comprendendo gli eventi molecolari la reazione potrà essere applicata e ottimizzata in modo mirato in futuro. Questo era lo scopo della tesi di Jannsen, che ha difeso con successo a Rostock nel 2023.
Allora come funziona una reazione del genere? L'inizio e la fine sono noti. Ciò che si sa anche di questa reazione è che ogni singolo atomo dei materiali di partenza si ritrova successivamente nel prodotto; i chimici la chiamano reazione “atomo-economica”. Ciò significa che nel corso della reazione l'idrogeno del legame N–H deve passare dal benzotriazolo al secondo materiale di partenza, l'allene.
Jannsen afferma:"Gli scienziati di Friburgo pensavano che il catalizzatore rompesse il legame azoto-idrogeno, cioè avvenisse una cosiddetta addizione ossidativa del benzotriazolo. I catalizzatori al rodio sono noti per questo tipo di reazione."
Jannsen ha testato l'idea facendo prima reagire il catalizzatore al rodio con un solo materiale di partenza, il benzotriazolo. Ha isolato campioni da questa reazione per la spettroscopia di risonanza magnetica nucleare (NMR) e l'analisi della struttura cristallina a raggi X. Il risultato:"Il legame NH non è affatto rotto. Il benzotriazolo rimane completamente intatto, si attacca solo al catalizzatore."
Il chimico ha poi scoperto che anche la seconda sostanza di partenza, allen, si lega al catalizzatore. Ed è qui che accade quanto segue:"Le due materie prime entrano in contatto diretto tra loro e il benzotriazolo trasferisce l'atomo di idrogeno, noto anche come protone, all'allene. Il catalizzatore si limita a trattenere le materie prime, ma non interviene direttamente in questo passaggio."
Jannsen ha poi motivato questa proposta in dettaglio utilizzando la meccanica quantistica, cioè modellando teoricamente il percorso della reazione.
Jannsen è rimasto sorpreso dal fatto che il catalizzatore abbia gestito il tutto in modo così semplice. Per i non addetti ai lavori, potrebbe sembrare un trucco con la corda chimica. In termini tecnici, tale processo è ben noto e si chiama protonazione.
Questo processo aveva un vantaggio. Jannsen afferma:"È interessante notare che le condizioni di reazione per la protonazione possono essere notevolmente migliorate aggiungendo un'altra fonte di protoni". Ad esempio, è riuscita a ridurre la temperatura di reazione da 80°C a temperatura ambiente aggiungendo un tipo di co-catalizzatore.
Jannsen scoprì anche che il benzotriazolo può anche bloccare il catalizzatore in determinate circostanze. Questo è il caso quando questa sostanza di partenza occupa il catalizzatore due volte, in modo che il suo partner di reazione, la brugola, non possa trovare uno spazio libero sul catalizzatore.
Ciò paralizza l'attività catalitica e porta al "consumo" del catalizzatore. "Probabilmente in questo caso è utile aggiungere semplicemente il materiale di partenza alla reazione in successione, in modo che il catalizzatore entri meno in contatto con esso", afferma Jannsen.
Ulteriori informazioni: Nora Jannsen et al, Il meccanismo dell'accoppiamento catalizzato da Rh(I) di benzotriazoli e alleni rivisitato:inibizione del substrato, spostamento del protone e ruolo delle specie cationiche e neutre, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.4c02679
Informazioni sul giornale: Giornale dell'American Chemical Society
Fornito da Leibniz Institute for Catalysis