MYC è la proteina informe responsabile del peggioramento della maggior parte dei casi di cancro umano. I ricercatori della UC Riverside hanno trovato un modo per frenarlo, offrendo speranza per una nuova era di trattamenti.
Nelle cellule sane, MYC aiuta a guidare il processo di trascrizione, in cui le informazioni genetiche vengono convertite dal DNA in RNA e, infine, in proteine. "Normalmente, l'attività di MYC è strettamente controllata. Nelle cellule tumorali diventa iperattiva e non è regolata adeguatamente", ha affermato Min Xue, professore associato di chimica dell'UCR.
"MYC è meno simile al cibo per le cellule tumorali e più simile a uno steroide che promuove la rapida crescita del cancro", ha detto Xue. "Ecco perché MYC è responsabile del 75% di tutti i casi di cancro nell'uomo."
All'inizio di questo progetto, il team di ricerca dell'UCR credeva che se fossero riusciti a smorzare l'iperattività di MYC, avrebbero potuto aprire una finestra in cui il cancro avrebbe potuto essere controllato.
Tuttavia, trovare un modo per controllare MYC è stato impegnativo perché, a differenza della maggior parte delle altre proteine, MYC non ha struttura. "È fondamentalmente un ammasso di casualità", ha detto Xue. "I percorsi convenzionali di scoperta di farmaci si basano su strutture ben definite e questo non esiste per MYC."
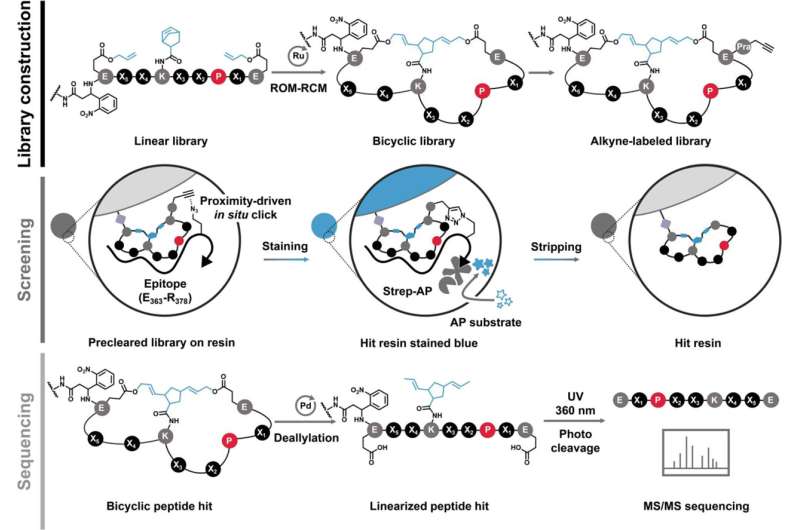
Un nuovo articolo nel Journal of the American Chemical Society , di cui Xue è l'autore senior, descrive un composto peptidico che si lega a MYC e ne sopprime l'attività.
Nel 2018, i ricercatori hanno notato che la modifica della rigidità e della forma di un peptide migliora la sua capacità di interagire con target proteici privi di struttura come MYC.
"I peptidi possono assumere una varietà di forme, forme e posizioni", ha detto Xue. "Una volta piegati e collegati per formare anelli, non possono adottare altre forme possibili, quindi hanno un basso livello di casualità. Questo aiuta con la rilegatura."
Nell'articolo, il team descrive un nuovo peptide che si lega direttamente a MYC con quella che viene chiamata affinità sub-micromolare, che si sta avvicinando alla forza di un anticorpo. In altre parole, è un'interazione molto forte e specifica.
"Abbiamo migliorato le prestazioni di legame di questo peptide rispetto alle versioni precedenti di due ordini di grandezza", ha detto Xue. "Ciò lo avvicina ai nostri obiettivi di sviluppo dei farmaci."
Attualmente, i ricercatori stanno utilizzando nanoparticelle lipidiche per fornire il peptide nelle cellule. Si tratta di piccole sfere costituite da molecole di grasso e non sono ideali per l'uso come farmaco. Guardando al futuro, i ricercatori stanno sviluppando una chimica che migliori la capacità del peptide piombo di penetrare all'interno delle cellule.
Una volta che il peptide è nella cellula, si legherà a MYC, modificando le proprietà fisiche di MYC e impedendogli di svolgere attività di trascrizione.
Il laboratorio di Xue presso l'UC Riverside sviluppa strumenti molecolari per comprendere meglio la biologia e utilizza tali conoscenze per effettuare la scoperta di farmaci. È da tempo interessato alla chimica dei processi caotici, cosa che lo ha attratto dalla sfida di domare MYC.
"MYC rappresenta il caos, fondamentalmente, perché manca di struttura. Questo, e il suo impatto diretto su così tanti tipi di cancro, lo rendono uno del Santo Graal dello sviluppo di farmaci antitumorali", ha detto Xue. "Siamo molto entusiasti che ora sia alla nostra portata."
Ulteriori informazioni: Zhonghan Li et al, Inibitori mirati al MYC generati da una libreria di peptidi biciclici stereodiversificati, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c09615
Informazioni sul giornale: Giornale dell'American Chemical Society
Fornito da Università della California - Riverside