Essendo il "Santo Graal" nel campo della chimica, l'attivazione catalitica del metano è stata un argomento di grande interesse nel campo della catalisi eterogenea. Gli esperimenti in fase gassosa forniscono una piattaforma ideale per esplorare i meccanismi di reazione catalitica e acquisire una comprensione approfondita delle strutture elettroniche.
Negli ultimi decenni sono state scoperte un gran numero di sostanze in grado di attivare il metano in fase gassosa e sono stati realizzati addirittura cicli catalitici completi per la conversione del metano. Il meccanismo di attivazione iniziale del legame C-H nel metano può essere suddiviso in trasferimento di atomo di idrogeno (HAT), trasferimento di elettroni accoppiati a protoni (PCET) e trasferimento di idruro (HT), e la costruzione di siti di attivazione a bassa energia è diventata una ricerca recente. hotspot.
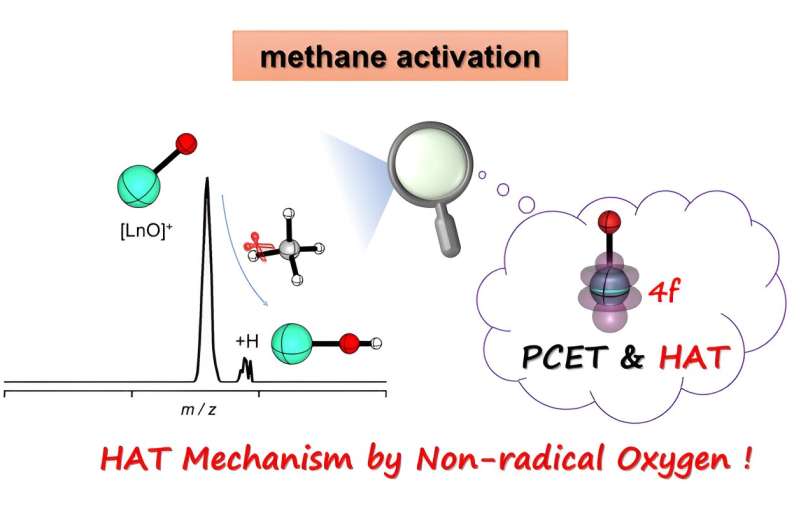
Recentemente, il gruppo di ricerca guidato dal professor Shao-Dong Zhou ha riferito sulla reazione di [LnO] + ioni (Ln =Sm-Lu) con metano e i risultati sperimentali hanno mostrato che [LnO] + gli ioni possono estrarre un atomo di idrogeno dal metano, con [EuO] + e [YbO] + mostrando la massima reattività.
I calcoli chimici quantistici hanno rivelato che [LnO] + gli ioni sono ioni triplamente legati con elettroni spaiati che occupano gli orbitali 4f. Nelle reazioni di [EuO] + /[YbO] + con il metano, uno dei legami Ln-O subisce la scissione omolitica, formando un radicale dell'ossigeno, attivando così il metano attraverso il meccanismo HAT.
In altri sistemi, l'attivazione del metano avviene tramite il meccanismo PCET attraverso la scissione eterolitica dei legami Ln-O. Vale la pena notare che dopo la formazione dello stato di transizione, l'occupazione degli orbitali 4f in [EuO] + /[YbO] + cambia da 4f 6 /4f 13 a 4f 7 /4f 14 , risultando in uno stato riempito a metà o completamente riempito degli orbitali 4f, stabilizzando lo stato di transizione e abbassando la barriera di reazione.
Ciò differisce dagli studi precedenti, in cui l’interazione tra metalli lantanidi e ligandi dell’ossigeno ha portato alla degenerazione degli orbitali 4f, riducendo la barriera di reazione piuttosto che la transizione elettronica 5d-4f. I risultati sperimentali e computazionali di questo articolo indicano che la modulazione razionale dell'occupazione degli orbitali 4f può essere utile per la progettazione di reazioni radicali.
I risultati sono pubblicati sulla rivista Science China Chemistry .
Ulteriori informazioni: Bowei Yuan et al, Attivazione del metano da parte di [LnO]+:le questioni orbitali 4f, Science China Chemistry (2023). DOI:10.1007/s11426-023-1801-4
Fornito da Science China Press