Gli scienziati dell'Università di Bath hanno utilizzato la natura come ispirazione per sviluppare un nuovo strumento che aiuterà i ricercatori a sviluppare nuovi trattamenti farmaceutici in un modo più pulito, più ecologico e meno costoso.
I trattamenti farmacologici spesso funzionano legandosi alle proteine coinvolte nella malattia e bloccandone l'attività, riducendo così i sintomi o curando la malattia.
Invece di utilizzare come farmaci le piccole molecole convenzionali, che non sono adatte a bloccare le interazioni tra le proteine, l'industria farmaceutica sta ora studiando il potenziale di produrre farmaci utilizzando piccole proteine note come "peptidi", che funzionano in modo simile.
Tuttavia, i peptidi e le proteine spesso non costituiscono farmaci molto buoni perché le loro strutture 3D possono disfarsi, sono sensibili alle alte temperature e può essere difficile penetrare nelle cellule del corpo, dove si trovano molti bersagli farmacologici interessanti ma impegnativi.
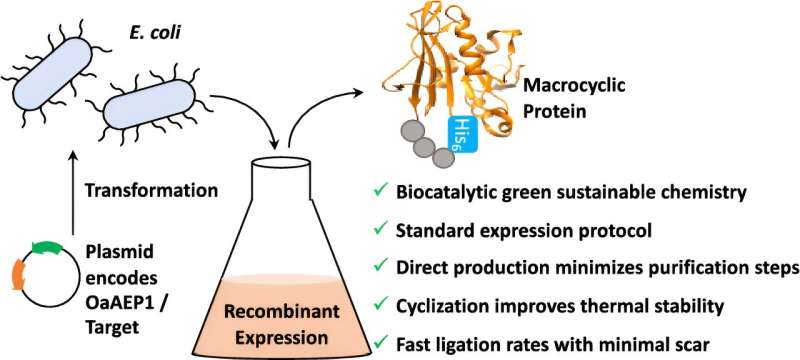
Ora, gli scienziati dell’Università di Bath hanno sviluppato un modo per aggirare questo problema; normalmente, le proteine e i filamenti peptidici hanno un inizio e una fine:unendo insieme queste estremità libere, è possibile creare proteine e peptidi "ciclici" molto rigidi che migliorano il calore e la stabilità chimica oltre a renderli più facili da inserire nelle cellule .
Hanno preso un enzima chiamato OaAEP1 da Oldenlandia affinis, un piccolo fiore viola che cresce ai tropici, e lo hanno modificato prima di trasferirlo nelle cellule batteriche. Queste colture batteriche sono state coltivate per produrre in serie una proteina unendo contemporaneamente le estremità in un unico passaggio.
Le piante possono eseguire questo processo in modo naturale, ma è lento e a basso rendimento. In alternativa, la ciclizzazione può essere eseguita chimicamente isolando l'enzima e quindi miscelando più reagenti in una provetta, ma ciò richiede più passaggi e utilizza solventi chimici tossici.
L’inserimento dell’intero processo in un sistema batterico aumenta la resa, utilizza reagenti più sostenibili e biologicamente compatibili e richiede meno passaggi. È quindi molto più semplice ed economico.
Per dimostrare l'approccio, gli scienziati hanno applicato la loro tecnologia batterica OaAEP1 a una proteina chiamata DHFR e hanno scoperto che unire le estremità della testa e della coda la rendeva più resistente ai cambiamenti di temperatura pur mantenendo la sua normale funzione.
Il professor Jody Mason, del Dipartimento di scienze della vita dell'Università di Bath, ha affermato:"Le proteine e i peptidi sono generalmente piuttosto sensibili al calore, ma la ciclizzazione li rende molto più robusti".
"La pianta Oldenlandia produce naturalmente proteine cicliche come parte di un meccanismo di difesa per scoraggiare i predatori."
"Così abbiamo sfruttato questo superpotere dei fiori modificando OaAEP1 e combinandolo con la tecnologia esistente per la produzione di proteine batteriche per creare uno strumento davvero potente che aiuterà l'industria della scoperta di farmaci."
Il Dott. Simon Tang, ricercatore associato presso il Dipartimento di Scienze della Vita dell'Università di Bath, ha affermato:"Le proteine e i peptidi sono molto promettenti come candidati farmacologici, ma un significativo collo di bottiglia per lo sviluppo di nuovi trattamenti terapeutici è la produzione di quantità sufficienti per raggiungere pazienti senza dover sostenere un costo astronomico."
"Il nostro nuovo processo lascia che i batteri facciano tutto il lavoro:il risultato è che è anche più pulito ed ecologico e, poiché richiede meno passaggi, è molto più semplice da eseguire."
"Siamo davvero entusiasti delle potenziali applicazioni di questo, non solo per l'industria farmaceutica ma anche per altri settori come l'industria alimentare, l'industria dei detersivi, la biotecnologia e la produzione di bioenergia."
I ricercatori hanno depositato un brevetto per la tecnica e hanno pubblicato il loro lavoro sulla rivista JACS Au .
Ulteriori informazioni: T. M. Simon Tang et al, Applicazione intracellulare di un'asparaginil endopeptidasi per la produzione di proteine cicliche ricombinanti testa-coda, JACS Au (2023). DOI:10.1021/jacsau.3c00591
Fornito dall'Università di Bath