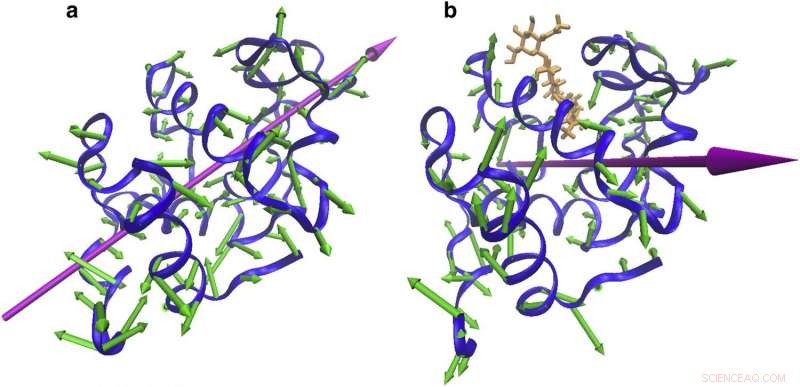
Cambiamenti nella direzione vibrazionale con il legame. Vibrazioni proteiche che indicano (a) un movimento di bloccaggio attorno al sito di legame a 55 cm?1 da NMA di CEWL libero e (b) una torsione attorno al sito di legame. Credito:ristampato con il permesso di Biophysical Journal.
In ogni momento all'interno del corpo umano, viene eseguita una danza accuratamente coreografata.
Le proteine scuotono i loro corpi e agitano le loro membra, il tutto con l'obiettivo di ottimizzare la loro interazione con altre molecole, comprese altre proteine. Questi piccoli movimenti, chiamate vibrazioni, consentire alle molecole di cambiare forma rapidamente per legarsi l'una all'altra, che a sua volta facilita compiti come l'assorbimento di ossigeno e la riparazione delle cellule.
L'efficienza del corpo nello svolgere queste funzioni dipende da quanto bene le proteine possono interagire.
Ma cosa rende una proteina una corteggiatrice migliore di un'altra?
Un nuovo studio fa luce su questa domanda, mostrando che in questo corteggiamento biologico, i passi di danza contano.
"Nel passato, la ricerca sulle vibrazioni proteiche si è concentrata molto sull'energia di quelle vibrazioni, ", afferma il capo scienziato Andrea Markelz, dottorato di ricerca, professore di fisica all'Università del Buffalo College of Arts and Sciences. "Ma quello che abbiamo scoperto è che la direzione del movimento sembra essere più importante. La direzione del movimento, la direzione in cui si muovono le diverse parti della proteina, può davvero determinare quanto bene una proteina svolge la sua funzione biologica".
I risultati aiutano a gettare le basi per lo sviluppo di farmaci mirati alle vibrazioni molecolari. Tali prodotti farmaceutici impedirebbero alle proteine di svolgere compiti che contribuiscono alla malattia.
"Abbiamo condotto la ricerca utilizzando una nuova tecnica che abbiamo sviluppato chiamata microscopia anisotropica terahertz (ATM), che rivela come la natura sfrutta i movimenti delle proteine per migliorare l'efficienza. Possiamo quindi ottimizzare questi movimenti per la medicina e la biotecnologia, " dice la prima autrice Katherine Niessen, un dottorando UB in fisica.
La ricerca, pubblicato il 14 marzo in Giornale Biofisico , è stato condotto da UB, l'Università di Perugia in Italia, e Istituto di ricerca medica Hauptman-Woodward. È stato finanziato dalla National Science Foundation (NSF).
Foxtrot o tango?
Lo studio si è concentrato sul lisozima dell'albume d'uovo di gallina, una proteina presente negli albumi.
Come primo passo nel loro progetto, gli scienziati hanno confrontato le vibrazioni regolari del lisozima con le vibrazioni del lisozima quando era legato a una molecola la cui presenza impediva alla proteina di svolgere i suoi normali compiti biologici.
Quello che gli scienziati hanno visto è che i lisozimi liberi e inibiti vibrano a energie simili, ma con direzioni di movimento distinte:il lisozima libero svolazzava con un'azione di sbattimento simile a una cerniera, come le ali di una farfalla, mentre il lisozima inibito si muoveva secondo uno schema più simile a una forbice.
"Il risultato è stato un cambiamento fondamentale rispetto alla visione convenzionale. Le vibrazioni hanno cambiato direzione, anche se l'energia dei movimenti è rimasta la stessa, " dice Markelz. (Aggiunge che come analogia, questo è simile a due persone che eseguono danze diverse:il foxtrot e il tango, per esempio, ma esercitando la stessa quantità di energia.)
La stessa dinamica è emersa quando il team ha confrontato il lisozima normale con un lisozima di albume d'uovo di gallina mutante che era più efficace nello svolgere il suo lavoro. I lisozimi mutanti e normali avevano le stesse energie vibrazionali, ma diverse direzioni vibrazionali.
Uno strumento chiavi in mano per misurare le vibrazioni
La ricerca sulle vibrazioni molecolari potrebbe aprire nuove strade per lo sviluppo di farmaci e la raccolta di energia artificiale (le vibrazioni potrebbero spiegare perché la fotosintesi è così efficiente). Ma storicamente, i minuscoli impulsi e palpitazioni all'interno delle proteine sono stati molto difficili da studiare.
Markelz spera di cambiare la situazione sviluppando uno strumento chiavi in mano che gli scienziati di tutto il mondo possono utilizzare per ricercare le vibrazioni.
Per studiare il lisozima dell'albume d'uovo di gallina, il suo team ha impiegato la tecnica ATM che il suo gruppo di ricerca ha sviluppato internamente. A differenza di altri metodi utilizzati per ricercare le vibrazioni proteiche, ATM consente agli scienziati di osservare non solo le energie vibrazionali, ma anche la direzione dei movimenti.
La NSF ha recentemente assegnato a Markelz quasi $ 400, 000 sovvenzione per commercializzare uno strumento ATM di facile utilizzo, che amplierebbe la capacità della comunità scientifica di esplorare le vibrazioni molecolari. Il dispositivo rappresenterebbe un grande passo avanti rispetto ad altri metodi esistenti, che forniscono solo una visione approssimativa delle vibrazioni e richiedono ambienti estremamente secchi e freddi e strutture costose, Markelz dice.